Industria y Mercado
¿Cuánto cuestan los ensayos clínicos? (How much do clinical trials cost?)
Martin L, Hutchens M, Hawkins C, Radnov A
Nature Reviews Drug Discovery, 2017;16:381–382 doi:10.1038/nrd.2017.70 Publicado en línea el 19 de mayo de 2017
Traducido por Salud y Fármacos
El costo de sacar medicamentos nuevos al mercado y realizar ensayos clínicos es una preocupación básica de las compañías farmacéuticas, que año tras año se siguen enfrentando al aumento de los costos de los ensayos clínicos debido a que los programas de desarrollo clínico son cada vez más complejos. Esta complejidad se debe a factores que incluyen un mayor escrutinio regulatorio, la creciente necesidad de demostrar no sólo la seguridad y la eficacia de los nuevos fármacos, sino también su valor (particularmente en comparación con tratamientos establecidos para enfermedades como la diabetes y la osteoporosis), y los retos asociados con realizar ensayos en subpoblaciones definidas de pacientes o en pacientes con enfermedades raras.
A pesar de la clara necesidad de entender los costos del desarrollo de fármacos y los factores responsables, ha habido un sorprendente vacío de información sobre el costo real de realizar ensayos clínicos. Sin tener puntos de referencia fiables, es difícil que las empresas identifiquen los puntos más complejos de sus procesos y logren preparar un plan correctivo. Además, la falta de información dificulta hacer proyecciones y planes de presupuestos, particularmente cuando se utilizan nuevos modelos de desarrollo o se llevan a cabo ensayos en áreas en las que una empresa tiene una experiencia limitada.
Con el objetivo de proporcionar a las empresas una línea de base comparativa sobre el costo de los ensayos clínicos, en 2016 el Grupo KMR llevó a cabo el famoso estudio de costos de ensayos clínicos. Esta evaluación proporcionó a los altos directivos de las principales empresas de biofarma información confiable sobre los costos de esta industria, que les serviría para poder evaluar su eficiencia operacional y hacer proyecciones financieras más precisas, así como evaluar con mayor eficacia el costo de conceder licencias y adquirir activos. A continuación, presentamos algunos de los hallazgos clave de este análisis.
Análisis
Los datos de 726 estudios de intervenciones en pacientes realizados entre 2010 y 2015 se obtuvieron directamente de siete grandes empresas (en 2016, según el ranking de ingresos, todas estaban entre las 20 primeras empresas de biofarma) (ver información adicional S1 en el artículo original para obtener más detalles). Se utilizó un proceso estandarizado para asignar los gastos atribuibles al desarrollo clínico -incluyendo personal, subcontratación y gastos- a cada uno de los ensayos utilizando la información sobre las horas trabajadas y los gastos directos. Este método inclusivo alivia los retos asociados con el análisis comparativo más tradicional que se venía utilizando. Por ejemplo, hasta la fecha, la mayor parte de la información de costos se limitaba a la inversión externa, que no sólo excluye gran parte del costo real (por ejemplo, los empleados de la empresa), sino que se vuelve más confusa cuando la externalización varía según el estudio (es decir, manteniendo los demás factores constantes, los estudios que subcontratan más, parecerán más costosos).
Este proceso detallado de recolección de datos permitió desglosar los costos totales de los ensayos por conceptos de gasto para cada ensayo: personal, subcontratación, subvención / contrato y otros gastos. La figura 1 muestra las proporciones de cada uno de esos conceptos de gasto para el conjunto de ensayos de fase III. El gasto de personal representa, como media, el 37% de los costes totales de un ensayo de fase III, mientras que la subcontratación y el gasto en subvenciones / contratos representan aproximadamente una quinta parte del coste total del ensayo.
Figura 1: Componentes del costo de los ensayos clínicos Fase III
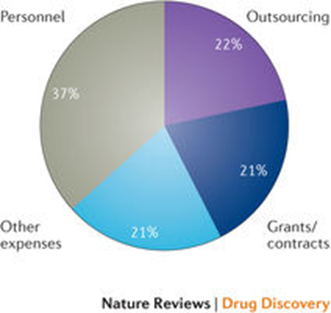
Datos procedentes de 273 estudios realizados en pacientes entre 2010 y 2015 (Ver los detalles de la información suplementaria S1 en el artículo original en inglés)
Los datos permiten evaluar el rendimiento de los costes de tres maneras: en primer lugar, comparando los costes de la cartera de ensayos clínicos de una empresa con los del grupo en general para comprender mejor cómo su perfil de costes difiere del de sus pares; en segundo lugar, evaluar el costo de la cartera de ensayos de una empresa dada en relación con su área terapéutica particular y, en tercer lugar, examinar el perfil de costos de los ensayos en términos de eficiencia operacional. Aunque los datos sobre el desempeño individual de las empresas incluidas en la base datos son confidenciales, los datos agrupados que se presentan aquí son útiles para comprender los principales componentes del costo, así como cuánto cuestan los ensayos clínicos.
Mediana de los costos de los ensayos clínicos. Para el primer tipo de evaluación, se pueden usar datos sobre la mediana del costo de los ensayos clínicos según su fase. Si se descubre que una empresa gasta más por ensayo, la causa puede explicarse por factores tales como el área terapéutica, los diferentes tipos de diseño de los ensayos o ineficiencias en los procesos operativos. Sin embargo, el resultado final será que, si por cualquier razón una empresa realiza ensayos más caros, se considerará menos productiva; es decir, incapaz de ejecutar el mismo número de ensayos por dólar.
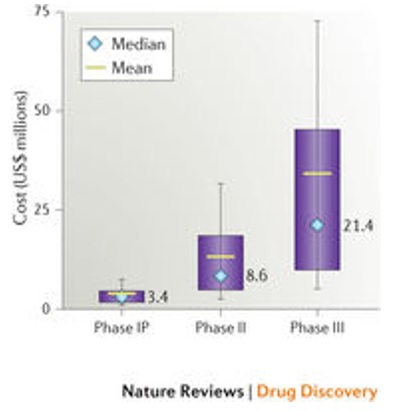
Para los ensayos incluidos en la base de datos, la mediana del costo de realizar un estudio desde que se aprueba el protocolo hasta que se concluye el informe final del ensayo clínico fue de US$3,4 millones para los ensayos de fase I que involucraron a pacientes, US$8,6 millones para ensayos de fase II y US$21,4 millones para ensayos de fase III (Figura 2).
Figura 2. Costos de los ensayos clínicos (en millones de US$)
| Factores | Descripción | Costo total del ensayo |
| Centro investigación | Número de centros donde se asignan pacientes aleatoriamente | |
| Sujetos | Número de pacientes aleatorizados | |
| Visitas | Número de visitas por paciente | |
| Duración | Duración del ensayo (desde que se aprueba el protocolo hasta el informe final del ensayo | |
| Tamaño de la molécula | Molécula pequeña vs molécula grande | NS |
| Enfermedad rara | Enfermedad rara vs no rara | NS |
| Diseño adaptativo | Diseño adaptativo vs no adaptativo | NS |
| Actividad en mercado emergente | Actividad en el mercado emergente vs no actividad | |
| Sujetos en mercado emergente | Porcentaje de pacientes en el mercado emergente | |
| Regiones | Número de regiones | |
| Países | Número de países |
Los datos proceden de 726 estudios realizados en pacientes entre 2010 y 2015. Las medianas y las medias están indicadas con rombos y líneas respectivamente. Las cajas indican los percentiles 25 a 75 y las líneas verticales indican los percentiles 10 y 90. Fase IP =estudio de fase 1 con pacientes. Para más detalles vea la información adicional S1 (cuadro) en el documento original.
No es de sorprender que gran parte de la variabilidad de estos costos esté relacionada con el diseño del ensayo y factores tales como el número de sujetos, centros de investigación y visitas (P ≤ 0,0001) (Cuadro1). También se utilizaron técnicas estadísticas para identificar los factores clave que influyen en el costo y que dependen de las opciones estratégicas que elige una empresa, como la selección de los países en los que van a realizar los ensayos clínicos. Este análisis reveló, por ejemplo, que el aumento del número de países y el uso de los mercados emergentes aumentaron el costo (Cuadro 1). Tener una mayor proporción de pacientes en mercados emergentes también tiende a alargar la duración del ciclo (Nat. Rev. Drug Disc. 16, 157, 2017), particularmente para los estudios de fase III. Esto indica que, si bien estos países son útiles para ampliar la población de pacientes, plantean problemas tanto por ampliar los plazos como por aumentar los costos
Los componentes que tienen un triángulo azul se asociaron con un aumento del costo del ensayo clínico (p ≤0,0001) NS= no significativo. Para más detalles ver información suplementaria S1 en el documento original.
Otro factor clave asociado a un mayor costo fue la duración del ensayo (Cuadro 1). Específicamente, cada mes adicional en la duración de un ensayo de fase III se traduce en una mediana de US$671.000 adicionales. Con esta línea de base, incluso pequeñas reducciones en la duración del ciclo podrían aportar beneficios significativos a los presupuestos generales para el desarrollo clínico.
También hubo factores que no tuvieron ningún efecto estadísticamente significativo en el costo total del estudio, como por ejemplo si el ensayo utilizó un diseño adaptativo, si era para una enfermedad rara o para un producto biológico (Cuadro 1). Sin embargo, aunque los estudios de enfermedades raras no se asociaron a diferencias en el costo total del estudio, tuvieron un costo subsidiado más elevado y estadísticamente significativo (P = 0,0003) por paciente, debido en parte a que los grupos de pacientes son más pequeños y a que los diseños son más complejos. De manera similar, los estudios con moléculas grandes también tuvieron costos de subvención significativamente más altos por sujeto (P = 0,004).
Desempeño operacional. Aunque los factores asociados al diseño son esenciales para cualquier evaluación de costos, no aportan información sobre el desempeño operacional de las empresas; es decir, cuán bien ejecutan los ensayos clínicos de acuerdo con el diseño elegido. Para evaluar el desempeño operacional, hicimos una regresión multivariada para obtener un modelo estadístico que explicara los factores esenciales relacionados con el diseño del protocolo (es decir, un modelo sencillo (véase la información complementaria S1 en el documento original para leer los detalles). El diseño sencillo utiliza las siguientes características del ensayo: tamaño del estudio (utilizando el volumen de los centros de investigación), el área terapéutica y la duración del tratamiento. Para los ensayos de las fases II y III, el modelo sencillo explica aproximadamente dos tercios y casi el 90% de la varianza en el costo total del estudio, respectivamente. La proporción inexplicada de la varianza (es decir, el 33% y el 10%) se debe al impacto que las estrategias operativas y de ejecución tienen sobre el costo total de cada estudio.
La eficiencia operativa de cada empresa incluida en la base de datos se calculó en base a la razón del gasto, calculando la proporción entre el gasto real y el programado (es decir, se deriva de un modelo). Esto demostró que a pesar de que la mayoría de los costos se explican por los parámetros de diseño del protocolo, todavía hay ineficiencias sustanciales en las operaciones en toda la industria. La disparidad en la eficiencia operacional (± 1 desviación estándar) entre las compañías en el conjunto de datos equivale a una diferencia de aproximadamente US$700 millones anuales en los costos totales de los ensayos clínicos de una empresa con el tamaño medio de las incluidas en esta base de datos.
Finalmente, identificamos las características comunes entre las empresas de alto y bajo rendimiento y encontramos varios temas interesantes. Por ejemplo, las empresas que gastan una mayor proporción de sus presupuestos de desarrollo clínico en la externalización obtuvieron mejores resultados al comparar los costos de los ensayos de fase I (R = -0,46), pero peor al comparar los costos de los ensayos de fase III (R = 0,38).
Además, las empresas que realizan ensayos para enfermedades raras tienen mayor probabilidad de ser menos productivas en la fase III (R = 0,67).
Para mejorar el desempeño
Comprender los factores que encarecen los ensayos clínicos es un esfuerzo complejo y detallado que requiere una metodología sólida para asegurar la comparabilidad entre las empresas y los ensayos. Esperamos que los datos proporcionados por nuestro análisis ayuden a las empresas a evaluar su desempeño e identificar áreas específicas para mejorar.
En general, existen tres grandes grupos de factores que pueden contribuir a mejorar el rendimiento: cambios a las características del diseño del ensayo (como el tamaño del estudio, el número de medidas de impacto y la duración del tratamiento), las opciones operativas (como la subcontratación y el uso de mercados emergentes) y reducciones en la duración del ensayo. Aunque las oportunidades para que las empresas individuales mejoren su desempeño deben ser entendidas a través de la evaluación minuciosa de sus propios datos sobre estos factores, nuestro análisis indica algunas áreas en las que podría ser particularmente útil enfocarse. Estas incluyen factores como la externalización durante las diferentes etapas del proceso de desarrollo clínico, el uso de mercados emergentes y aspectos operacionales que reducen la duración del ensayo. Comprender las relaciones entre todos los factores también será crucial para tomar decisiones óptimas.
Declaración de conflictos de intereses. Los autores de este artículo son empleados del grupo KMR, una consultora líder en gestión que se centra en evaluaciones comparativas, análisis y gestión del rendimiento para las empresas biofarmacéuticas.