El 29 de abril de 2020, el Representante de Comercio de EE UU (USTR) publicó su Informe Especial 301. Una copia en PDF del informe está disponible en este enlace (https://www.keionline.org/wp-content/uploads/2020_Special_301_Report.pdf). KEI ha compilado las copias anuales del Informe Especial 301 desde que se empezaron a publicar en 1989, y otros datos adicionales, en esta página https://www.keionline.org/ustr/special301.
Abajo se muestra un mapa realizado por KEI de los países incluidos en la Lista de Vigilancia o en la Lista de Vigilancia Prioritaria, de 1989 a 2020 (para ver la progresión hay que ir a la página original, aquí reproducimos solo el ultimo mapa). Rojo significa Lista de Vigilancia Prioritaria y naranja la Lista de Vigilancia. Este año, el USTR enumera un total de 33 países que representan más del 35% del PIB mundial. Diez de estos 33 países aparecen en la categoría de Lista de Vigilancia Prioritaria.
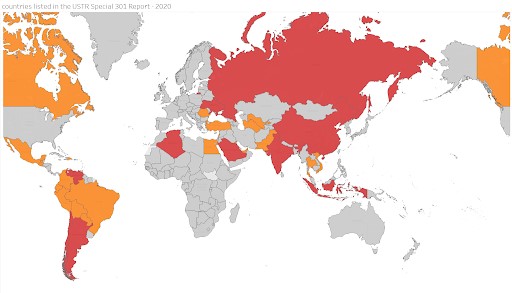
La Lista de Vigilancia Prioritaria se mantuvo sin cambios en relación con 2019, excepto Kuwait, que se trasladó a la Lista de Vigilancia. De la Lista de Vigilancia se eliminó a Costa Rica, Grecia, Jamaica y Suiza, y se añadió a Trinidad y Tobago.
Sorprendentemente, los términos “coronavirus”, “COVID-19”, “SARS-Cov-2”, “pandemia” o “emergencia” no se mencionan en la edición 2020 de un informe dedicado en parte al acceso a tecnologías de salud en todo el mundo. Este año, el Subcomité Especial 301 celebró su audiencia pública el 26 de febrero de 2020. Algunas de las organizaciones que testificaron, incluidas Public Citizen y KEI, plantearon cuestiones relacionadas con COVID-19, durante la audiencia y en los comentarios posteriores a la audiencia.
Licencias obligatorias
Como en años anteriores, el USTR se queja de los países que están utilizando o promoviendo el uso de las flexibilidades permitidas por las normas internacionales de propiedad intelectual. Este año, el informe cita “acciones de socios comerciales para emitir injustamente y amenazar o alentar a otros a emitir licencias obligatorias”, destaca a Chile, Colombia, Egipto, El Salvador, India, Indonesia, Malasia, Rusia, Turquía y Ucrania. Este lenguaje es casi una copia literal de un párrafo similar en el informe de 2019, aunque agrega a Egipto a la lista.
Por ejemplo, las acciones de los socios comerciales para emitir injustamente, amenazar con emitir o alentar a otros a emitir licencias obligatorias generan serias preocupaciones. Dichas acciones pueden socavar la propiedad intelectual del titular de una patente, reducir los incentivos para invertir en investigación y desarrollo de nuevos tratamientos y curas, trasladar injustamente la carga de financiar dicha investigación y desarrollo a pacientes estadounidenses y a aquellos en otros mercados que respetan adecuadamente la propiedad intelectual, y desalientan la introducción de nuevos medicamentos importantes en los mercados afectados. Para mantener la integridad y la previsibilidad de los sistemas de propiedad intelectual, los gobiernos deben usar licencias obligatorias solo en circunstancias extremadamente limitadas y después de hacer todo lo posible para obtener la autorización del titular de la patente en términos y condiciones comerciales razonables. Dichas licencias no deben usarse como herramienta para implementar políticas industriales, ni para ofrecer ventajas a las compañías nacionales, o como mecanismo de presión en las negociaciones de precios entre gobiernos y titulares de derechos. También es fundamental que los gobiernos extranjeros garanticen la transparencia y el debido proceso en cualquier acción relacionada con las licencias obligatorias. EE UU continuará monitoreando los desarrollos y participando, según corresponda, con sus socios comerciales, incluyendo Chile, Colombia, Egipto, El Salvador, India, Indonesia, Malasia, Rusia, Turquía y Ucrania.
En medio de una pandemia, quejarse de las licencias obligatorias es, en el mejor de los casos, una declaración desatinada. En marcado contraste con el USTR, la Secretaría de la Organización Mundial del Comercio (OMC) ha mencionado recientemente en su sitio web que las licencias obligatorias, así como las licencias voluntarias, se encuentran entre las herramientas de política que los países pueden usar para garantizar que los medicamentos y otras tecnologías de salud estén disponibles y sean asequibles para sus ciudadanos. Existen varios motivos legítimos que justifican el uso de licencias obligatorias sobre invenciones patentadas, especialmente en este momento. EE UU debería estar entre los países que consideran estas medidas en lugar de intimidar a otros por hacerlo.
Producción local
En este momento, los países tienen razones obvias y legítimas para preocuparse por la producción local de tecnologías relacionadas con COVID-19. Durante mucho tiempo, el USTR ha criticado a los países que en su legislación de patentes incluyen requisitos de producción local, especialmente en el contexto de las licencias obligatorias, pero quejarse de esto este año es particularmente imprudente.
De todos modos, el Informe Especial 301 de 2020 menciona la producción local o la transferencia de tecnología varias veces. Por ejemplo, Indonesia aparece en la Lista de Vigilancia Prioritaria. Entre las cuestiones planteadas en el informe figuran las “barreras de acceso al mercado” en Indonesia, que incluyen “requisitos para la producción doméstica y la transferencia de tecnología para productos farmacéuticos y otros sectores”.
En Indonesia, los titulares estadounidenses de derechos siguen enfrentando desafíos con respecto a la aplicación adecuada y efectiva de la protección a la propiedad intelectual (PI), así como en el acceso justo y equitativo al mercado. Estas preocupaciones incluyen la piratería y la falsificación generalizada y, en particular, la falta de adopción de medidas contra la falsificación peligrosa de productos. Para abordar estos problemas, Indonesia necesitaría hacer y financiar un gran esfuerzo, bien coordinado para lograr que se respeten las medidas de protección de la propiedad intelectual, incluyendo sanciones disuasorias a los infractores de los derechos de propiedad intelectual en los mercados físicos y en línea. La Ley de Patentes de Indonesia de 2016 sigue planteando inquietudes, incluso con respecto a los criterios de patentabilidad para innovaciones incrementales, los motivos y procedimientos para la emisión de licencias obligatorias, y los requisitos de divulgación de las invenciones relacionadas con el conocimiento tradicional y los recursos genéticos. La ley de Indonesia sobre indicaciones geográficas (IG) cuestiona el efecto de los nuevos registros de IG sobre los derechos de las marcas preexistentes, y la capacidad para usar nombres comunes de alimentos. Indonesia también carece de un sistema efectivo para proteger contra el uso comercial injusto, así como para divulgar sin autorización los resultados no divulgados de ensayos u otros datos generados para obtener el permiso de comercialización de productos farmacéuticos y agroquímicos. La piratería en línea es una preocupación, particularmente a través de dispositivos y aplicaciones de piratería, y la grabación ilegal y el uso sin licencia del software siguen siendo problemáticos. Además, EE UU sigue preocupado por una serie de barreras de acceso al mercado de Indonesia, incluyendo ciertas medidas relacionadas con las películas, y los requisitos para la producción doméstica y la transferencia de tecnología para productos farmacéuticos y otros sectores.
Propiedad intelectual y salud
En años anteriores, el Informe Especial 301 había incluido una sección sobre “propiedad intelectual y salud”, en general indicando que los comentarios presentados durante el proceso de revisión “destacaron las preocupaciones que surgen en la intersección de la política de PI y la política de salud”. Esta sección permanece en el informe de este año, pero sin hacer la referencia a la OMPI o la OMS que se había incluido en informes anteriores.
Informe especial 301 de 2019
El gobierno de EE UU trabaja para garantizar que las disposiciones de sus acuerdos comerciales bilaterales y regionales, así como la participación de EE UU en organizaciones internacionales, incluyendo las Naciones Unidas e instituciones relacionadas, como la OMPI y la OMS, sean coherentes con las políticas de EE UU relacionadas con la propiedad intelectual y la política de salud, sin impedir que sus socios comerciales tomen las medidas necesarias para proteger la salud pública. Consecuentemente, la Oficina del Representante de Comercio de EE UU continuará cooperando estrechamente con las agencias pertinentes para garantizar que se aborden los desafíos de salud pública y se apoye la protección y el cumplimiento de la PI como uno de los mecanismos para promover la investigación y la innovación.
Precios y reembolsos
Aunque se supone que el Informe Especial 301 se refiere a la propiedad intelectual, el USTR también presta atención a la fijación de precios y al reembolso de las tecnologías sanitarias. Este año, el término “reembolso” aparece 16 veces en el informe. El USTR argumenta que en algunos mercados extranjeros los sistemas de precios y reembolso “no están basados en el mercado” o no “reconocen adecuadamente el valor de los medicamentos y dispositivos médicos innovadores”. A lo que se refiere el USTR cuando dice que estos sistemas de reembolso no “reconocen adecuadamente el valor” de estos productos es que los mercados extranjeros deberían aceptar precios más altos. Algunos de los países criticados en el informe 2020 por sus programas de reembolso son Japón, Corea, Nueva Zelanda y Turquía.
Durante mucho tiempo, EE UU ha instado a Japón a implementar políticas de reembolso y precios estables y predecibles que recompensen la innovación y ofrezcan incentivos para que las empresas inviertan en la investigación y el desarrollo de dispositivos médicos avanzados y de productos farmacéuticos innovadores. Las reformas al sistema de reembolso que adoptó Japón en 2017 representan un retroceso en los avances obtenidos anteriormente en esta área. EE UU tiene serias preocupaciones con respecto a los cambios recientes en las políticas de la Prima de Mantenimiento de Precios (PMP), un mecanismo diseñado para acelerar la introducción de medicamentos innovadores en el mercado japonés. Varios de los factores que se tienen en cuenta en los cálculos de PMP, como el número de ensayos clínicos locales y el lanzamiento de productos, parecen facilitar que las compañías japonesas califiquen para la prima. Los resultados del reembolso bajo el sistema PMP sugieren que las empresas estadounidenses, especialmente las pequeñas y medianas empresas, están en desventaja en comparación con las empresas japonesas. Las revisiones de PMP también pueden introducir mucha incertidumbre en el precio de los productos farmacéuticos patentados, lo que socava la planificación de inversiones de gran capital en la innovación farmacéutica y en los ensayos clínicos. La implementación de la evaluación de la costo-efectividad, un sistema de evaluación de la tecnología en salud, puede agregar incertidumbre a las compañías que venden medicamentos y dispositivos médicos altamente innovadores y de alto impacto en Japón. Cualquier evaluación del gasto sanitario debe evaluar de manera justa todas las áreas que contribuyen a los costos a largo plazo, en lugar de enfocarse en un sector en particular. Estas preocupaciones seguirán siendo una prioridad para EE UU, por lo que continuará monitoreando de cerca la situación a medida que se vaya desarrollando.
EE UU ha instado a Corea a considerar seriamente las preocupaciones de las partes interesadas y garantizar que el reembolso farmacéutico es justo, transparente, no discriminatorio y reconoce el valor de la innovación. En marzo de 2018, las negociaciones para mejorar e implementar mejor el TLC entre Corea-EE UU (KORUS) concluyeron con el compromiso de Corea de enmendar su política de precios premium para medicamentos innovadores globales con el objetivo de garantizar un tratamiento no discriminatorio y justo de los productos farmacéuticos y dispositivos médicos, incluyendo los productos y dispositivos importados. La implementación de este compromiso por parte de Corea ha dado como resultado enmiendas que parecen hacer que muy pocas, o ninguna, compañía o productos califiquen para un precio premium. Es fundamental que Corea implemente este compromiso de manera plena y de buena fe, al mismo tiempo que aborda las continuas preocupaciones de EE UU con respecto a la falta de transparencia y previsibilidad, y la necesidad de reconocer adecuadamente el valor de los productos farmacéuticos y de los dispositivos médicos innovadores en las políticas de precios y reembolso de Corea, y su metodología subyacente.
Existen preocupaciones de larga data sobre las políticas y el funcionamiento de la Agencia de Administración Farmacéutica de Nueva Zelanda (PHARMAC), que incluyen, entre otras cosas, la falta de transparencia, imparcialidad y previsibilidad del régimen de precios y reembolso de PHARMAC, así como aspectos negativos en el clima general para los medicamentos innovadores en Nueva Zelanda.
Las partes interesadas continúan planteando inquietudes con respecto al proceso de inspección a las plantas de manufactura de productos farmacéuticos de Turquía. EE UU insta a Turquía a aprovechar su reciente adhesión al Convenio de Inspección Farmacéutica y al Esquema de Cooperación (PIC / S) y a reconocer los certificados de Buenas Prácticas de Manufactura emitidos por cualquiera de los miembros de PIC / S para mejorar los plazos regulatorios. Además, los problemas actuales de reembolso siguen funcionando como barreras de acceso al mercado.
Revisiones fuera de ciclo
Este año, el USTR anunció una revisión fuera de ciclo de Arabia Saudita para considerar la “protección contra el uso comercial injusto, así como la divulgación no autorizada de los resultados no divulgados de ensayos u otros datos generados para obtener el permiso de comercialización de productos farmacéuticos”.
Desde 2006, las reglamentaciones sauditas han previsto la protección contra el uso comercial desleal, así como la divulgación no autorizada, de resultados no divulgados de ensayos u otros datos generados para obtener el permiso de comercialización. Sin embargo, desde 2016, el SFDA (autoridad saudita de alimentos y medicamentos) ha concedido el permiso de comercialización a empresas nacionales confiando en los resultados no divulgados de los ensayos de otras empresas u otros datos sobre sus productos, a pesar de la protección proporcionada por las regulaciones sauditas. EE UU ha estado hablando con Arabia Saudita sobre esta cuestión, pero acciones continuas del SFDA y la falta de reparación para las empresas afectadas han intensificado las preocupaciones. Además, la agencia nacional de compras de suministros médicos (National Unified Procurement Company for Medical Supplies), también supervisada por el Ministerio de Salud, adjudicó licitaciones nacionales a algunas de estas empresas nacionales. EE UU insta a Arabia Saudita a que garantice la protección contra el uso comercial desleal, así como la divulgación no autorizada de resultados no divulgados de ensayos clínicos u otros datos generados para obtener el permiso de comercialización, teniendo en cuenta sus obligaciones internacionales.
En 2019, Malasia fue objeto de una revisión fuera de ciclo para considerar si el país estaba proporcionando una “protección adecuada y efectiva de la propiedad intelectual, incluyendo las patentes”. Este año, el USTR anunció que extenderá esa revisión fuera de ciclo y “presionará a Malasia para que complete acciones para resolver completamente estas preocupaciones en el corto plazo”.