Un artículo publicado en el NEJM destaca la importancia de financiar los sistemas para caracterizar el perfil la seguridad de las vacunas después de su comercialización, pues los ensayos clínicos previos a la autorización tienen tamaños de muestra, duraciones de seguimiento y heterogeneidad poblacional limitados [1]. A continuación, resumimos los puntos más importantes.
Se requiere analizar los efectos adversos que surgen después de la vacunación que no se han detectado durante los ensayos clínicos, y determinar si podrían tener una relación causal con las vacunas administradas. Cuando los efectos adversos se vinculan con las vacunas, se debe determinar el riesgo atribuible a la vacunación y el mecanismo biológico. Estos conocimientos ayudarían a desarrollar vacunas más seguras, caracterizar las contraindicacions de la vacunación y establecer los niveles de compensación para los que se ven afectados por los eventos adversos.
Si bien el Comité Asesor sobre Prácticas de Inmunización (ACIP) reconoce esta necesidad, actualmente hay pocos recursos para hacer estudios de seguridad posteriores a la autorización de las vacunas. Consecuentemente, lo que se sabe sobre la seguridad de las vacunas con frecuencia proviene de evidencia epidemiológica que se recoge tardiamente, que suele ser inadecuada para determinar causalidad y no no permite tener un conocimiento completo de los mecanismos biológicos que intervienen. Por ejemplo, aunque finalmente hubo más de una docena de estudios epidemiológicos bien realizados que llevaron al Instituto de Medicina (IOM, ahora la Academia Nacional de Medicina) a concluir que las vacunas contra el sarampión, las paperas y la rubéola y el timerosal que está presente en las vacunas no causaban autismo, los resultados no estuvieron disponibles hasta años después de que estas preocupaciones se plantearan públicamente. La lentitud de la ciencia contribuyó a generar preocupación y a que disminuyera la cobertura inmunizacional, así como a los brotes de sarampión.
El IOM encontró que la evidencia que aportaron 234 revisiones de vacunas y de sus resultados para la salud que se realizaron entre 1991 y 2012 era inadecuada para probar o refutar la causalidad de 179 (76%) de las relaciones exploradas. En 2024, las Academias Nacionales de Ciencias, Ingeniería y Medicina emitieron un informe sobre los posibles daños de las vacunas contra la covid-19 y no pudieron encontrar evidencia suficiente de relación causal para 65 conclusiones (76%) (solo hubo evidencia suficiente para 20 conclusiones).
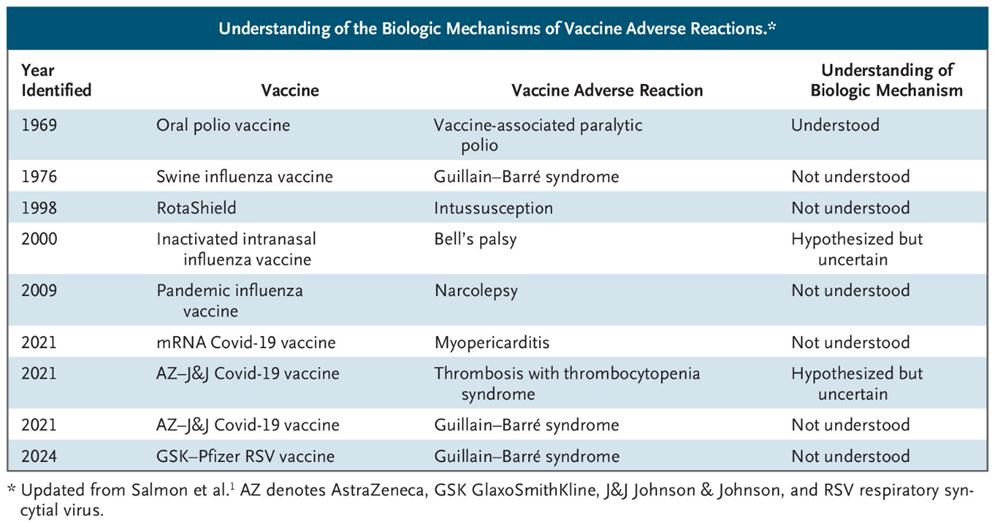
El mecanismo biológico sigue sin esclarecerse para la mayoría de las reacciones adversas a las vacunas, en particular, el síndrome de Guillain-Barré después de la administrar la vacuna contra la gripe en 1976-1977 y varias otras vacunas, la miocarditis después de las vacunas contra la covid-19 basadas en ARNm y la invaginación intestinal después de la primera vacuna contra el rotavirus. (véase la tabla).
Históricamente, los Centros para el Control y la Prevención de Enfermedades (CDC) y la FDA han liderado la vigilancia y la investigación de la seguridad de las vacunas posteriores a la autorización, a través del sistema de vigilancia pasiva del Sistema de Notificación de Reacciones Adversas a las Vacunas (VAERS), que es se utiliza para detectar señales que requieren mayor investigación. Pero, aunque el VAERS es grande y los eventos pueden ser reportados en forma oportuna, pocos informes VAERS incluyen los hallazgos clínicos o de laboratorio específicos para determinar causalidad.
La vigilancia activa mediante bases de datos de atención médica, como Vaccine Safety Datalink y el Sistema de Efectividad y Seguridad de Productos Biológicos (BEST) de la FDA, administrado por los CDC y la FDA, tiene la capacidad de determinar o descartar asociaciones entre las vacunas y los eventos adversos. También se han utilizado otras bases de datos gubernamentales (por ejemplo, la base de datos de Medicare) para la vigilancia activa, y los CDC realizan una evaluación clínica de los eventos adversos a través de la Red de Evaluación de la Seguridad de la Inmunización Clínica (Clinical Immunization Safety Assessment Network).
A pesar de que el número de vacunas que se administran rutinariamente a niños y adultos ha ido en aumento, el presupuesto del CDC para dar seguimiento a estas vacunas se ha mantenido estancado en alrededor de US$20 millones por año.
La investigación sobre la seguridad de las vacunas posterior a la autorización requiere una financiación adecuada y oportuna, directamente vinculada a la introducción de nuevas vacunas. Se podría utilizar el dinero del impuesto especial que se recaba por cada dosis de vacuna rutinaria administrada, que se ha estado reservando para compensar a los que sufren eventos adversos a causa de las vacunas para hacer estos estudios de seguridad. El 30 de abril de 2023, ese fondo había alcanzado los US$4.300 millones. El articulo explica como este uso sería consistente con la intención de los legisladores que aprobaron el programa de impuestos a las vacunas que se estableció en 1986.
Fuente Original