A finales de diciembre de 2023, el tribunal de apelaciones de París declaró a la farmacéutica Servier culpable de todos los delitos penales de los que se la acusaba, a saber: “engaño agravado”, “lesiones culposas agravadas y homicidio culposo”, “fraude”, y la “obtención indebida” y renovación del permiso de comercialización de benfluorex (Mediator, desde su retiro del mercado) [1]. Jean-Philippe Seta, el anterior director ejecutivo de la empresa, recibió una condena de cuatro años de prisión en suspenso (con un año de arresto domiciliario con monitoreo electrónico), y se ordenó a Servier pagar una multa de más de €9 millones. El tribunal de apelaciones también ordenó a la farmacéutica pagar €420 millones para reembolsar a los prestadores obligatorios y suplementarios de seguros médicos [2,3]. La empresa y su anterior director ejecutivo apelaron esta sentencia a la Corte Suprema [1].
Debajo reproducimos fragmentos de las 1101 páginas de la sentencia, que ilustran la postura de los jueces de la apelación sobre la culpabilidad de Servier. También agregamos notas de los editores para proporcionar contexto cuando sea útil [2].
“(…) Al principio, los efectos supresores del apetito de Mediator eran deseados y publicitados. Los procedimientos judiciales revelaron, en primer lugar, que al principio benfluorex se desarrolló en el contexto de la investigación para descubrir un medicamento con propiedades supresoras del apetito, entre otros efectos. En una nota con fecha del 26 de abril de 1967 (…), Jean-Claude Le Douarec [nota de los editores: en ese momento, trabajaba como farmacólogo en Servier] explicó claramente que la investigación que había descubierto el benfluorex había sido impulsada por el deseo de hallar ‘un nuevo derivado de Pondéral’ [nota de los editores: fenfluramina], un supresor del apetito comercializado por Servier, pero que no tuviera los mismos efectos secundarios. En una de sus audiencias, Brigitte Riveline [nota de los editores: en ese momento trabajaba como investigadora en Servier] confirmó (…) que ‘se esperaba que benfluorex fuera un anorexígeno [nota de los editores: supresor del apetito] que no tuviera los mismos efectos sedantes observados con Pondéral’. (…)
En segundo lugar, se descubrió que, al principio, publicitaban esta propiedad [supresora del apetito]. Por ejemplo, la ficha del producto de benfluorex —un documento interno de Servier— aseguraba que las “posibles indicaciones terapéuticas” eran ‘analgésico/anorexígeno’ (…). Ocurrió lo mismo con las fichas del producto de (…) dos metabolitos del benfluorex, que se metabolizaban como norfenfluramina, una molécula con conocidos efectos supresores del apetito y que participa en el efecto supresor del apetito de la fenfluramina y la dl-fenfluramina en su forma dl-norfenfluramina. También se publicitó esa misma propiedad en la ficha del producto (…) de JP1513, una sal metanosulfónica del benfluorex (…). De la misma manera, tanto la solicitud de la patente presentada el 5 de abril de 1967 como la ‘patente especial de medicamento’ presentada el 3 de diciembre de 1967 mencionaban, entre otros, los efectos supresores del apetito de benfluorex. (…)
Finalmente, se supo que, en 1970, al solicitar la denominación farmacológica común internacional, Servier aseguró que el medicamento actuaba como un ‘tratamiento para la obesidad’.
Se confirmaron sus propiedades tanto en estudios en animales como en humanos. (…). Sobre todo, el juzgado citó muchos estudios en humanos, examinados durante la exposición de los hechos, que demostraron, tanto antes como después de presentar la solicitud de permiso de comercialización, que existía un efecto supresor del apetito que en ocasiones provocaba un descenso considerable de peso: desde el estudio de 1968 de Marcel Plauchu, seguido del estudio de Marcel Zara, hasta el estudio de Asmal et al. publicado en septiembre de 1977 (…). Varios de estos estudios compararon el medicamento con otros supresores del apetito comercializados durante la década de 1970, como Linyl [fentermina], Insoral [fenformina] y Pondéral, y se demostró que los efectos eran similares. (…)
Estas propiedades supresoras del apetito también fueron respaldadas, empíricamente, por muchos médicos que se ‘especializaban’ en la pérdida de peso, generalmente con fines estéticos, y que recetaban Mediator fuera de indicación. Servier estaba al tanto de esto, y el juzgado observó que ninguno de los documentos internos que abordaban este asunto sugerían que la decisión de esos médicos era injustificada: lo veían únicamente como una amenaza para la permanencia del medicamento en la lista de los que se podían reembolsar. (…)
Se apunta a un mercado más atractivo. (…) En noviembre de 1969, Servier decidió eliminar el uso del término ‘anorexígeno’ y reposicionar al benfluorex en el área terapéutica de los trastornos del metabolismo de lípidos y carbohidratos.
Diferentes memos y documentos internos de ese año decisivo muestran que, a pesar de que para ese momento se había confirmado clínicamente el efecto supresor del apetito del medicamento y se había examinado su magnitud, su efecto sobre el metabolismo seguía siendo muy hipotético (…).
Si bien en los registros de una reunión estratégica del 29 de diciembre de 1969 se documentó que (…) ‘en este momento, nuestros razonamientos bioquímicos clínicos se relacionan directamente con la pérdida de peso…’ y que ‘los razonamientos más atractivos que debemos establecer son… la corrección del efecto del metabolismo de lípidos… sobre la captación periférica de glucosa, la mejora del control de la diabetes…’, decidieron presentar a benfluorex como un ‘corrector del metabolismo de lípidos’. En otras palabras, priorizaron un efecto que no había sido demostrado sobre el que se había observado clínicamente. El juzgado indicó que, algunos días antes, en un memo con fecha del 8 de diciembre de 1969, Janine Servier [nota de los editores: la esposa de Jacques Servier] había alegado, en contra de la lógica científica, que benfluorex no tenía futuro como supresor del apetito y que solo funcionaría como complemento de un tratamiento antidiabético, un efecto que aún no se había demostrado. Sugirió que se solicitara la aprobación rápidamente y que después se intensificara ‘un enorme programa de investigación’ para confirmar lo que en ese momento era solo una hipótesis científica.
Los diferentes documentos también indican que Servier no tenía la intención de desarrollar un nuevo supresor del apetito (un sector comercial donde ya tenía a Pondéral), sino que prefiría apuntar a un mercado más atractivo dados los precios y la duración del tratamiento, tras lo cual surgiría obviamente la cuestión del reembolso.
En 1973, Servier solicitó el permiso de comercialización para tres indicaciones en el área de los trastornos metabólicos.
Cuando presentó la solicitud de permiso de comercialización, Servier tenía un conocimiento detallado del fármaco: sabía que se metabolizaba en norfenfluramina, que era muy similar a las demás fenfluraminas y que tenía efectos sobre la pérdida de peso, si bien eran débiles. (…)
Se ocultaron deliberadamente sus propiedades supresoras del apetito. (…) Si bien Servier tenía derecho a restringir su solicitud de permiso de comercialización a los trastornos metabólicos, también mantuvo un silencio absoluto sobre los efectos supresores del apetito del medicamento, a pesar de que los conocía bien.
No se incluyó ninguno de los estudios que se referían explícitamente a los efectos supresores del apetito de benfluorex en animales y humanos para respaldar la primera solicitud de permiso de comercialización. La empresa solo presentó estudios que, cuando se referían al efecto sobre el peso, especificaban el origen de tal efecto.
Esta omisión no fue la única manera en la que se ocultaron las propiedades supresoras del apetito del medicamento. Las evaluaciones expertas del Dr. Jean Charpentier [nota de los editores: un farmacólogo que ejecutaba estudios para Servier durante ese tiempo] incluyeron los resultados del estudio Schmitt, pero se eliminaron las referencias específicas a las dosis supresoras del apetito (…). De la misma manera, mientras que estas evaluaciones expertas incluían datos de un estudio de Jacques Duhault [nota de los editores: jefe del laboratorio de investigación sobre diabetes y obesidad de Servier desde 1963 hasta 2000], se habían eliminado las líneas y los cuadros sobre la anfetamina (…). Finalmente, incluyeron los datos de un estudio de Iterc [nota de los editores: un estudio, financiado por Servier, sobre los efectos “conductuales y neurofisiológicos” del medicamento en ratas, ratones y conejos], pero que no hizo referencia a sus efectos supresores del apetito.
La naturaleza deliberada de este ocultamiento también se confirmó durante el juicio penal contra Jean Charpentier, quien declaró que él y algunas personas de la empresa buscaban ‘un mecanismo para perder peso que sacara al medicamento de la clase de las anfetaminas’ (…). La evidencia presentada también muestra claramente que, durante todo el ciclo de vida de Mediator, Servier evitó sistemáticamente presentar estudios que sugirieran que tenía efectos supresores del apetito. (…)
La preocupación continua por ocultar las propiedades supresoras del apetito del benfluorex no fue impulsada únicamente por el deseo de Servier y de su fundador de posicionar a Mediator en el área terapéutica del metabolismo de lípidos y carbohidratos. También era necesario porque no querían divulgar el papel de la norfenfluramina (que era responsable del efecto supresor del apetito del benfluorex y de las fenfluraminas) como metabolito principal del benfluorex.
Al no revelar esos efectos, Servier eludió la curiosidad sobre su causa: dicha curiosidad pudo haber hecho que se investigara a tiempo el papel de la norfenfluramina en el mecanismo de acción de Mediator, ya que la magnitud de los efectos adversos de esta molécula había sido aparente desde inicios de la década de 1960, al grado de que se interrumpieron los ensayos clínicos con esta sustancia.
Se oculta la similitud entre el metabolismo de benfluorex y el de las fenfluraminas. (…) Si bien Servier nunca negó explícitamente la presencia de este metabolito en común, mantuvo sistemáticamente cierta ambigüedad sobre el metabolismo de benfluorex en sus interacciones con las autoridades regulatorias, lo que le permitió ocultar, tanto de los pacientes como de los médicos, la similitud entre el metabolismo del benfluorex y el de las fenfluraminas. (…)
Esta ‘renuencia’ a presentar claramente los hechos también se ilustra por los problemas de comunicación sobre el estudio Gordon y Vis realizado en 1993. (…) Jean-Philippe Seta también reconoció (…) que ‘el estudio Gordon muestra claramente niveles idénticos de circulación de norfenfluramina tras la administración de fenfluramina y de benfluorex en dosis terapéuticas’. (…)
La evidencia presentada también deja claro que este estudio no se reportó espontáneamente a las autoridades regulatorias, particularmente como parte de la solicitud para renovar el permiso de comercialización que se presentó el 24 de enero de 1997. (…)
Esta ambigüedad permitió que Servier evitara incluir a la norfenfluramina como uno de los metabolitos del benfluorex en el RCP [resumen de las características del producto] del medicamento, como había hecho con Isoméride [dexfenfluramina]. En un sentido más amplio, permitió que la empresa ocultara de los pacientes y los médicos las similitudes entre el metabolismo de benfluorex y el de la fenfluramina o la dexfenfluramina. (…)
Se conocía el riesgo de hipertensión arterial pulmonar (HAP). La evidencia presentada se concentra principalmente en el caso de HAP reportado por el CRPV [nota de los editores: Centro Regional de Farmacovigilancia] en junio de 1999, en el Hospital Saint-Antoine de Paris. Si bien este fue el primer caso reportado de HAP en el que Mediator era el único medicamento que tomaba el paciente, está claro que el medicamento había aparecido en reportes anteriores desde 1989. Es verdad que cada uno de estos reportes se referían al uso de otros medicamentos, incluyendo a los que tenían efectos supresores del apetito que podrían haber participado en la aparición de la HAP. Pero desde la perspectiva de la farmacovigilancia, es por lo menos sorprendente que no se haya investigado la posible participación de Mediator.
En primer lugar, el tribunal indicó que, al menos en Francia, Mediator ya aparecía en reportes desde 1989, es decir, casi al mismo tiempo que Pondéral e Isoméride. En segundo lugar, algunos de los reportes indicaban que el paciente había tomado Mediator durante más tiempo o antes que Isoméride, un medicamento que también estaba tomando. Sin embargo, en cada ocasión se consideró que los casos eran provocados principalmente por Isoméride, tal vez debido al hecho de que el posicionamiento de Mediator en el mercado hacía que no se lo considerara un supresor del apetito.
Para ese momento, Servier no solo no hizo nada por poner a las autoridades sanitarias en conocimiento de los paralelos científicos que se podían trazar entre las fenfluraminas y el benfluorex, en particular debido a la existencia en común de un metabolito muy activo, la norfenfluramina. Además, contrario a su respuesta en 1970, eligió evitar que se instigara cualquier estudio interno sobre el benfluorex y el riesgo de HAP. El juzgado indicó que, en el ínterin, se había otorgado el permiso de comercialización al medicamento y estaba generando ganancias considerables. (…)
Se conocía el riesgo de valvulopatía. (…) Los procedimientos judiciales y la evidencia presentada mostraron que, para 1995 a más tardar, Servier estaba plenamente consciente del riesgo asociado al uso de medicamentos de la clase de la fenfluramina con relación a la HAP, y, para 1997 a más tardar, del riesgo relacionado con la valvulopatía. (…)
Por lo tanto, desde 1995 y, con seguridad, desde 1997, dada la similitud química de los medicamentos que pertenecen a la clase de las fenfluraminas, Servier debería al menos haber informado a la agencia regulatoria, los médicos y los pacientes sobre este riesgo, y recomendado que se restringiera su uso.
En 1999, ocurrieron dos casos ‘puros’ (en los que Mediator era el único medicamento que tomaba el paciente) que debieron haber hecho inevitable el retiro del mercado del medicamento, al igual que ocurrió con Pondéral e Isoméride, sobre todo teniendo en cuenta las alternativas terapéuticas disponibles (las mismas que se propusieron en 2003 para ‘justificar’ la posibilidad de retirarlo del mercado español).
Una política sistemática de negar los riesgos. (…) Los procedimientos judiciales muestran que, cada vez que la evidencia científica comprometía a una fenfluramina, Servier atacaba al estudio en cuestión, afirmando que no era confiable o no era decisivo.
Esta negación sistemática, incluso de los resultados de los estudios realizados por la misma empresa, muestran que Servier eligió sistemáticamente priorizar sus intereses económicos sobre la seguridad de los consumidores de sus medicamentos.
Manteniendo el medicamento en el mercado a toda costa. (…) La evidencia presentada muestra claramente que, en la década de 2000, lejos de considerar cualquier restricción al uso de Mediator, Servier se preparó para seguir desarrollando el medicamento. En el plan estratégico a tres años creado por el Dr. Denys Schutz [nota de los editores: el director comercial de Servier responsable de la promoción de Mediator] con fecha del 14 de abril de 2008, Schutz escribió que estaba revisando las ventas de Mediator estimadas para el año fiscal en curso y para los siguientes, y que ‘el tiempo parece estar de nuestro lado: nos permite prepararnos para el relanzamiento de su reputación como un medicamento para tratar la diabetes, que está programado para la primavera de 2008’. También esperaba que los resultados del primer estudio Moulin y los muy esperados resultados del estudio Regulate respaldarían la reevaluación de la indicación de Mediator para la diabetes tipo 2, ‘culminando en una reevaluación del nivel de su “beneficio clínico real” [nota de los editores: el que determina la Autoridad de Salud de Francia (HAS)] para tratar esta enfermedad, que protegerá su precio y su idoneidad para ser reembolsado’ (…).
El papel central de Jacques Servier. (…) La evidencia presentada revela que fue Jacques Servier quien, en 1969, tomó la decisión de reposicionar al benfluorex como un medicamento para tratar la diabetes y de ‘eliminar’ el uso del término ‘supresor del apetito’, a pesar de que, en ese entonces, como se expuso arriba, se habían observado clínicamente sus efectos sobre la pérdida de peso, pero no sus efectos sobre el metabolismo de lípidos y carbohidratos.
También fue Jacques Servier quien, como jefe farmacéutico, firmó la solicitud de permiso de comercialización para el medicamento el 29 de noviembre de 1973, acompañándolo de estudios en los que se ocultaron cuidadosamente las referencias, incluso las más pequeñas, al efecto supresor del apetito. También fue él quien, al responder a la solicitud de las autoridades regulatorias para recibir más información como parte de la evaluación durante la primera solicitud, no mencionó a la norfenfluramina a pesar de que se interrogó a la empresa sobre la relación química entre el benfluorex y la fenfluramina. (…)
Entonces, Jacques Servier no solo dirigió la solicitud para incluir a Mediator en la lista de medicamentos reembolsables mediante el sistema de seguro médico nacional, sino también las solicitudes de renovación de 1984, 1987, 1989 y 1992, y en cada ocasión aprobó la presentación de documentos que no contenían información sobre los efectos secundarios supresores del apetito del medicamento.
Una clara intención de engañar a los consumidores. (…) La empresa no solo no hizo nada para prevenir o limitar el riesgo para los pacientes, sino que, al mismo tiempo, mantuvo una política consistente, no para evaluar el nivel del riesgo realizando estudios de seguridad, sino ampliando las indicaciones de Mediator y, cuando menos, manteniendo a Mediator en el mercado a pesar de que sus efectos presuntos eran débiles. (…)
De esa manera, las señales de advertencia sobre los riesgos se minimizaron y se dio prioridad a las oportunidades de desarrollo. (…)
Así se demostró que Servier adoptó una postura ‘flexible’ frente a las indicaciones del medicamento y que se preocupaba más por el desarrollo de ‘beneficios’, en el sentido económico del término, que por los riesgos, en este caso, lamentablemente, en el sentido científico del término.
La grave naturaleza de los delitos cometidos. (…) La gravísima naturaleza de los delitos que el juzgado consideró que Servier cometió no necesitan mucha más explicación.
El primer motivo, el más triste: las consecuencias físicas de tomar Mediator. (…) Muchas víctimas que presentaron evidencia durante el juicio describieron, en primer lugar, cada una con sus propias palabras, la agonía de vivir con una espada de Damocles sobre sus cabezas. En segundo lugar, cuando se presentó la enfermedad, que sentían como si descendieran lentamente a un infierno, caracterizado por una movilidad cada vez más reducida, un sufrimiento cada vez mayor. Y, si se sometían a una cirugía, debían aguantar las difíciles consecuencias del tratamiento que a menudo les permitía solo sobrevivir, pero no tener una vida plena.
La segunda razón es, además de las consecuencias directas que padeció cada víctima individualmente, la desconfianza que este caso generó sobre los que participan en el protocolo asistencial. Muchas de las víctimas, y otras personas, sintieron que debían enfrentarse a una agencia regulatoria que no podía cumplir con su papel en la farmacovigilancia, a médicos que prescribían un medicamento que podía ser mortal sin preocuparse demasiado por la molécula que estaban prescribiendo y a las farmacéuticas que priorizan sus intereses económicos sobre los intereses de los pacientes. Esta desconfianza en todo el sistema de salud es una tragedia en sí misma, ya que provoca que los pacientes cuestionen sistemáticamente los mensajes sobre la prevención y el cuidado de la salud que reciben de los profesionales de la medicina, con el riesgo de dañar su salud y la de otros cuando las advertencias sean sobre el tratamiento de enfermedades infecciosas. (…)
La tercera razón es la duración y la escala del fraude, perpetrado no solo contra las autoridades de salud, sino más gravemente contra miles de pacientes durante un período de varias décadas. Es precisamente este aspecto el que define mejor la conducta de los acusados.
Efectivamente, durante todos estos años, a pesar de que conocían el engaño al introducir a Mediator en el mercado, las empresas acusadas no solo lo mantuvieron en el mercado, sino que intentaron seguir desarrollándolo, para el detrimento de la salud pública. Desde 1995 en adelante, siguieron comercializándolo a pesar de que los riesgos ya eran evidentes, poniendo primero sus intereses industriales y comerciales. (…)
La cuarta razón es el impacto económico de comercializar un producto con el financiamiento del sistema de seguro médico nacional. Al percibir fraudulentamente grandes sumas de dinero de este sistema, la empresa robó el dinero de quienes lo pusieron ahí, en otras palabras, el de casi toda la sociedad francesa”.
Referencias seleccionadas de la búsqueda bibliográfica de Prescrire
Una relación química obvia (An obvious chemical relationship)
Prescrire International 2024; 33 (265): 305
Desde 1977, la publicación médica francesa Pratiques había señalado la “relación química obvia” entre la fenfluramina y benfluorex.
“Servier afirma que ‘Mediator es resultado de una década de investigación’. Pero ¿por qué no dicen que, en términos químicos, Mediator es un derivado de anfetaminas y de otro medicamento de la empresa, del supresor del apetito Pondéral?
Dejaremos que lo juzguen ustedes mismos:
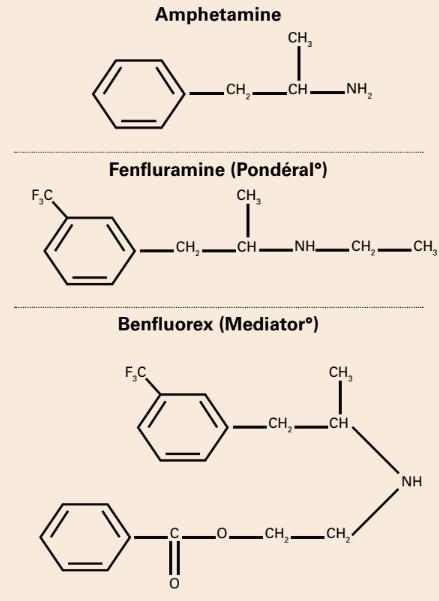
En otras palabras: Mediator = Pondéral + ácido benzoico unido al final de la cadena” [1,2].
Referencias