Investigaciones
Lo que los ensayos con Gardasil podrían no haber detectado
(What the Gardasil testing may have missed)
Frederik Joelving
Slate, 17 de diciembre de 2017
https://slate.com/health-and-science/2017/12/flaws-in-the-clinical-trials-for-gardasil-made-it-harder-to-properly-assess-safety.html
Read a companion piece from Slate’s science editor on this investigation.
Traducido por Salud y Fármacos
No hay evidencia de que la vacuna contra el VPH cause daños graves, pero una investigación concluye que los ensayos no fueron diseñados para evaluar adecuadamente su seguridad.
Hace tres años, en un soleado día de otoño, cuando Kesia Lyng tenía 30 años, recibió la visita de su hermana menor, Eva. Eran amigas íntimas, y mientras estaban sentadas en la mesa de la cocina del departamento de Lyng, Eva enfrentó a su hermana, afectada por una enfermedad crónica, con un hecho doloroso: “Casi no puedes cuidar de tus propios hijos”, le dijo. “No puedes seguir con tantas cosas”.
Lyng, que vivía con su esposo y sus dos hijos en una zona humilde de Copenhague, Dinamarca, llevaba años enfrentando problemas de salud inexplicables: dolores articulares y musculares que surgían y desaparecían, fuertes dolores de cabeza y un agotamiento aplastante que ni siquiera durmiendo muchísimas horas se solucionaba. Estaba trabajando a tiempo parcial en la cocina de la guardería de su hija, el último de una serie de trabajos extraños. Pero, una vez más, sus días de enfermedad se volvían a multiplicar. A menudo llamaba a su marido al trabajo, lloraba de cansancio y pedía que la recogieran. En casa, estaba agotada, sin energía para limpiar, cocinar o meter a los niños en la cama. En su historia clínica, que compartió conmigo, su médico señaló que estaba “pasando por un momento muy difícil” y que le preocupaba perder su trabajo si pedía una baja por enfermedad.
Cuando tenía un mal día, los síntomas de Lyng eran incapacitantes. “Tu cuerpo está tan cansado que casi no te puedes mover. Todo duele. Duele solo estirar, duele levantarse. Tus pies se sienten como bloques grandes y pesados. Hay una sensación de ardor en el cuerpo y da la sensación de que los músculos están a punto de sufrir un calambre. Incluso las cosas pequeñas, como ir y comprar leche, pueden ser totalmente abrumadoras”, me dijo recientemente. “Me he sentido increíblemente frustrada con mi cuerpo, porque es muy limitante”.
El problema comenzó a fines de 2002, justo antes de que Lyng cumpliera 19 años. Al principio se sentía como si tuviera una gripe, pero no mejoraba. Por las mañanas, su cuerpo estaba rígido y dolorido, y levantarse era cada vez más difícil. Cuando lograba levantarse e ir a la escuela, a menudo se quedaba dormida durante la clase. Si se aventuraba a salir a más de unos pocos minutos de la casa, tenía que tomar una siesta en un banco del parque o en un café para recuperar la energía necesaria para volver. Finalmente, abandonó la escuela.
Su abrupta transformación desconcertó a la gente con la que se relacionaba. Vieron como una marimacho gregaria se convertía en alguien que rompía citas, pasaba gran parte de su tiempo en la cama y usaba analgésicos sin parar. “Pensamos que era una depresión”, recordó su amiga Nanna Voltolina. “No podía hacer las mismas cosas que el resto de nosotros. Para mí fue difícil saber que le pasaba”.
Justo antes de que Lyng se enfermara, se había inscrito para participar en un ensayo clínico de una vacuna que en ese momento era experimental: se suponía que Gardasil de Merck evitaría la infección por el virus del papiloma humano o VPH, una enfermedad de transmisión sexual. El virus no causa daños a la gran mayoría de personas. Pero algunos tipos de VPH pueden provocar verrugas genitales, y se ha descubierto que otros intervienen en casi todos los casos de cáncer de cuello uterino, un tumor maligno que afecta a 6 de cada 1.000 mujeres en algún momento de su vida. La abuela de Lyng había muerto de cáncer de cuello uterino el año anterior, por lo que cuando llegó una carta ofreciéndole US$500 si participaba en un ensayo internacional muy importante de Gardasil, la decisión fue fácil. Recibió su primera inyección de la vacuna en el Hospital Hvidovre en Copenhague el 19 de septiembre de 2002.
Los síntomas empezaron a surgir poco después de su segunda inyección el 14 de noviembre. Nunca disminuyeron. No fue sino hasta 2016 que recibió su diagnóstico: síndrome de fatiga crónica (SFC). Un problema poco entendido que una vez muchos desestimaron como si se tratara de un problema psicológico, pero ahora se reconoce como una enfermedad grave, de largo plazo, que puede originarse en respuestas inmunes anormales. No tiene tratamiento.
Durante los últimos años, Lyng ha estado preguntándose si hay una conexión entre su enfermedad y la inmunización con Gardasil. Sus dolencias evocan descripciones que aparecen en cientos de noticias de mujeres que también recibieron la vacuna, así como varios informes de caso de alrededor del mundo. A medida que estas historias comenzaron a aparecer en los titulares, las tasas de vacunación contra el VPH en Dinamarca y en otros lugares se derrumbaron y estalló la controversia. Muchos señalaron, con razón, que solo se trataba de casos anecdóticos, y que ninguno aportó datos que probaran que la vacuna era realmente la causante del daño. Las mujeres podrían haberse enfermado de todos modos, como podría haberlo hecho Lyng; de hecho, un estudio epidemiológico reciente no detectó un aumento del riesgo de SFC en las niñas noruegas que se vacunaron con Gardasil.
También es cierto que más de 80 millones de niñas y mujeres han recibido la vacuna contra el VPH, y la gran mayoría no han sufrido más que una incomodidad temporal en el sitio de la inyección. En un comunicado enviado por correo electrónico, Merck dijo que tenía “confianza” en el perfil de seguridad de Gardasil, que “se estableció en ensayos clínicos con más de 25.000 mujeres y hombres” y se analizó en varios estudios de farmacovigilancia. También señaló que los reguladores no encontraron respaldo científico para algunas de las preocupaciones más discutidas, que consistían en un par de trastornos neurológicos graves en las niñas vacunadas. En dos ocasiones, la empresa me hizo hincapié en que, según la Agencia Europea de Medicamentos (EMA), los beneficios de las vacunas contra el VPH “siguen superando sus riesgos”. Las autoridades sanitarias de todo el mundo comparten esta opinión. Han expresado repetidamente que los exhaustivos ensayos clínicos aleatorios a los que se sometieron las vacunas antes de su comercialización ofrecen garantías. Durante mucho tiempo, los investigadores han considerado que estos estudios son el mejor criterio para juzgar si algo representa un riesgo real o es simplemente fruto del azar. Como señala el Instituto Nacional del Cáncer de los NIH en su sitio web, las tres vacunas contra el VPH que hoy se encuentran en el mercado “han sido testadas en decenas de miles de personas en EE UU y en muchos otros países”. Hasta el momento, no se ha demostrado que estas vacunas causen efectos secundarios graves”.
Slate realizó una investigación de ocho meses y descubrió que los principales ensayos de Gardasil estaban viciados desde su inicio y que los reguladores permitieron que se utilizaran métodos poco confiables para evaluar la seguridad de la vacuna. Si bien estos defectos no implican que Gardasil cause las enfermedades raras e invalidantes reportadas por los medios, son preocupantes. Los funcionarios de salud pública utilizan ensayos como estos para establecer la seguridad y, como lo demuestra la declaración de Merck mencionada anteriormente, tranquilizar al público cuando surgen inquietudes como las que rodean al Gardasil. Un diseño defectuoso puede complicar ambas tareas.
Lo que convierte al caso de Lyng en algo especial es que se enfermó durante el ensayo clínico; de hecho, el mayor ensayo clínico aleatorizado controlado con placebo de Gardasil, años antes de que se aprobara la vacuna (que ocurrió en 2006, tanto en Europa como en EE UU). Los reguladores de medicamentos tienden a prestar mucha más atención a los posibles efectos secundarios que surgen durante los estudios pre-comercialización, que es en el que Lyng participó, en lugar de los que aparecen después de que se haya establecido que el producto es seguro y se haya comercializado. Pero los reguladores nunca se enteraron de la difícil situación de Lyng. De hecho, sus repetidas quejas de síntomas debilitantes ni siquiera se registraron en el ensayo como posibles efectos secundarios (“eventos adversos”, en lenguaje médico).
La experiencia de Lyng no es única. Entrevistas con cinco participantes en el estudio y más de 2.300 páginas de documentos obtenidos de hospitales y autoridades de salud a través de solicitudes de libertad de información sugieren que los ensayos clínicos con Gardasil de Merck eran algo defectuosos. Para rastrear la seguridad de su producto, el fabricante de medicamentos utilizó un método complicado que imposibilitó que se hiciera una evaluación objetiva y solo permitió que se informaran los posibles efectos secundarios durante algunas semanas, cuando los ensayos eran de varios años. Durante el resto del tiempo, los investigadores decidían individualmente si informaban un problema médico como un evento adverso o no – esencialmente como un efecto secundario potencialmente vinculado a la vacuna que debería ser evaluado. Los otros problemas de salud se reportaban en el documento “nuevo historial médico”, que estaba reservado para problemas que no guardaban relación con la vacuna.
El diseño de este estudio colocó el carro delante del caballo, pidiendo a los investigadores que decidieran qué síntomas podrían ser efectos secundarios, en lugar de rastrearlos todos de la misma manera. Si bien la empresa ahora dice lo contrario, en el protocolo confidencial que presentó a los reguladores para su aprobación, no hay ninguna indicación de que fuera a utilizar el “nuevo historial médico” para evaluar la seguridad de la vacuna. Y difícilmente podría haberse calificado como tal: el documento asignó solo una línea por entrada, sin medir la gravedad de los síntomas, su duración, el resultado, ni la gravedad general del evento. Aunque posteriormente la empresa quisiera utilizar esos datos para evaluar la seguridad, no podría hacer un análisis significativo por la falta de detalles.
Durante una revisión de la solicitud de comercialización de Gardasil 9, la última versión de la vacuna, los reguladores europeos expresaron preocupación por los métodos de Merck, pero no han hecho públicos sus desasosiegos. En un informe interno de la EMA de 2014 sobre Gardasil 9, obtenido a través de una solicitud de libertad de información, los expertos principales calificaron el enfoque de la compañía como “no convencional y subóptimo” y dijeron que generaba cierta “incertidumbre” sobre los resultados de seguridad. Los inspectores del ensayo clínico de EMA realizaron observaciones similares en otro informe, señalando que el procedimiento de Merck “no es un método óptimo para recopilar datos de seguridad, especialmente los efectos secundarios no sistémicos que podrían aparecer mucho después de la administración de las vacunas”.
“Si yo fuera un sujeto de investigación, me sentiría traicionado”, me dijo Trudo Lemmens, bioéticista y profesor de derecho y política de salud de la Universidad de Toronto. “Si el propósito de un ensayo clínico es establecer la seguridad y eficacia de un nuevo producto, ya sea una vacuna u otra cosa, esperaría que reunieran todos los datos relevantes, incluyendo si tenían efectos secundarios o no”.
Merck, que fuera de EE UU y Canadá se conoce como Merck Sharp & Dohme, no abordó las preocupaciones de seguridad de la EMA; pero dijo que sus ensayos clínicos, donde sea que se lleven a cabo, se adhieren a las “leyes, regulaciones y directrices,” y solo se realizan tras haber recibido la aprobación de los reguladores y los comités de ética. La compañía también enfatizó que “la recolección de Nuevo Historial Médico se hizo durante cada visita, y era obligatoria para todos los sujetos del estudio. El nuevo historial médico incluye la recopilación de eventos adversos no graves”.
Cuando le pedí a la EMA que ampliara sus observaciones confidenciales, me dijeron por correo electrónico que los inspectores involucrados, después de todo, consideraron que los datos del ensayo se podían utilizar. La compañía, durante las discusiones previas a la aprobación, había apaciguado con éxito a la agencia. “La aclaración del solicitante de que la recopilación de nueva historia médica era obligatoria para todos los sujetos, y no parecía ser recogida pasivamente, sino durante cada visita de estudio, resultó ser tranquilizadora”, me informó EMA. “Por lo tanto, parecía que la vigilancia de seguridad utilizada durante los ensayos captó todos los eventos médicamente relevantes”. La agencia no comentó las limitaciones de confiar en “nuevo historial médico” en lugar de informar directamente sobre los eventos adversos.
La infranotificación de los eventos adversos, en la medida en que ocurrió aquí, no es nueva en medicina. Los investigadores que realizan ensayos clínicos suelen pasar por alto síntomas de los participantes, dicen los investigadores, y es posible que la información que recopilan no siempre vea la luz del día. Una revisión en 2016 [1] encontró “evidencia sólida de que gran parte de la información sobre eventos adversos se queda sin publicar y que el número y el rango de eventos adversos es mayor en las versiones no publicadas que en las publicadas del mismo estudio”. En 2009, el Dr. John Ioannidis de la Universidad de Stanford resumió el problema de forma sucinta en una editorial de Archives of Internal Medicine [2] titulado “Eventos adversos en ensayos aleatorizados: descuidados, restringidos, distorsionados y silenciados”.
Cómo se manejan los eventos adversos durante la realización de los ensayos clínicos, y cuál es su impacto está mucho menos claro. Los síntomas, ¿se registran como entidades separadas cuando en realidad son parte de una gran constelación de problemas de salud? ¿Aparecen como ocurrencias inofensivas, que aparecen una sola vez cuando de hecho son, o pueden llegar a ser, crónicas? ¿Y cuántos problemas de seguridad simplemente se pierden por el breve periodo de seguimiento?
El de Lyng no fue un caso aislado: al menos otras cinco mujeres danesas dicen que desarrollaron problemas crónicos de salud durante el ensayo. Future 2, como se le conoce, inscribió a más de 12.000 mujeres jóvenes de 13 países, incluyendo EE UU. Fue el mayor de los dos ensayos clínicos principales aleatorizados y controlados con placebo de Gardasil, los ensayos que técnicamente se conocen como ensayos pivotales – que Merck realizó para apoyar la solicitud de comercialización de la vacuna. (El otro estudio, con menos de la mitad del tamaño, se denominó Future 1). Juntos, los dos ensayos representan una gran parte de los datos que los reguladores de medicamentos de EE UU y Europa utilizaron para juzgar la seguridad de Gardasil antes de su aprobación.
En el Hospital de la Universidad de Aalborg, uno de los dos sitios donde se realizó el ensayo Future 2 en Dinamarca, Miam Donslund comenzó a experimentar síntomas persistentes de gripe, así como dos infecciones, una de las cuales requirió hospitalización, poco después de recibir la vacuna. Estos incidentes se registraron, pero nuevamente solo como “nuevo historial médico,” lo que significa que no se procesaron como eventos adversos.
Donslund, ahora de 38 años, me dijo que se cansó tanto durante el ensayo que en un momento la acusaron de ser drogadicta. Un año después de recibir la vacuna, desarrolló severos dolores que por un tiempo la obligaron a usar una silla de ruedas; hoy usa muletas regularmente. Los médicos le dijeron que podía tener artritis psoriásica, pero nunca recibió un diagnóstico definitivo. Más de doce años después, “trabajo dos días a la semana y el resto del tiempo estoy en casa en la cama y no puedo hacer las cosas más básicas”, dijo.
Stine Sørensen, de 34 años, recibió su primera dosis de Gardasil unos meses después de Lyng, también en el Hospital Hvidovre. Alrededor de este tiempo, comenzó a experimentar molestias generalizadas, dolores de cabeza y una fatiga profunda que a menudo la hacía faltar a la escuela. “Mi mamá y papá me preguntaron, ‘Stine, ¿estás drogada?’ Y recuerdo claramente que me enojé mucho”, me dijo. Sørensen, que ahora trabaja bajo un acuerdo especial para personas con enfermedades crónicas, dice que le contó sus problemas durante el ensayo al personal del estudio; pero los registros no mencionan ninguno de ellos. (Las tres mujeres recibieron la vacuna durante el ensayo).
El investigador del ensayo que se ocupó tanto de Lyng como de Sørensen, la Dra. Anette Kjærbye-Thygesen, obstetra ginecóloga de Hvidovre, no quiso ser entrevistada para este artículo. En un correo electrónico, un oficial de prensa del hospital me dijo: “Con respecto al registro de varios síntomas y datos de salud, el médico declara que ha seguido el protocolo del ensayo”. El hospital también se negó a responder a mis preguntas.
Según el Dr. José Montoya, profesor de medicina de la Universidad de Stanford y experto en el síndrome de fatiga crónica (SFC), establecer un vínculo entre la vacuna contra el VPH y el SFC no es demasiado descabellado,. La afección generalmente comienza con un insulto al sistema inmune: una infección grave, un accidente automovilístico, un embarazo. Los primeros síntomas son parecidos a la gripe, pero los meses pasan y la paciente se da cuenta de que no está mejorando. En unas pocas personas genéticamente predispuestas, Montoya me dijo, es “biológicamente plausible” que la vacuna, que imita una infección natural, también desencadene una respuesta inmune lo suficientemente potente como para provocar el SFC. Para averiguar si ese es el caso, los investigadores del ensayo necesitarían seguir cuidadosamente los síntomas de los participantes “durante al menos un año”, dijo.
Montoya también fue rápido en decirme que está “a favor de la vacuna” y que no cree que la gente deba dejar de recibirla. Su entusiasmo por afirmar ese punto subraya un problema mayor para entender las deficiencias de la investigación de Merck: reconocer cualquier incertidumbre sobre la seguridad de la vacuna puede ser muy difícil para las autoridades sanitarias, sobre todo porque el miedo al autismo, que ya ha sido descartado [3], continúa avivando los sentimientos antivacunas entre los padres. Hoy, la conversación está polarizada, o bien cree que las vacunas son categóricamente seguras, o cree que son tan peligrosas que las evita, aunque conlleve un riesgo personal significativo.
Pero esta es una dicotomía falsa que contradice la complejidad de la medicina. La seguridad no es absoluta. Al igual que los medicamentos, hay muchos tipos de vacunas, cada una con su propio conjunto de riesgos y beneficios que se relacionan con su uso específico en individuos particulares. Y desafortunadamente, nuestro conocimiento sobre los efectos secundarios a menudo es lamentablemente incompleto. Para Lemmens, especialista en bioética de la Universidad de Toronto, la renuencia a tener una discusión franca sobre la seguridad de Gardasil es contraproducente. “Cuando no hablamos públicamente de sus posibles problemas, hacemos un flaco servicio a la ciencia, y caemos en el juego de los anti-vacunas”, me dijo.
Antes de que se los enviara, Lyng nunca había visto los documentos sobre su participación en el ensayo clínico, que son propiedad de Merck. Cuando los miramos juntos, en un día templado en agosto, ella se puso visiblemente molesta. “¿De qué sirve testar una vacuna si no registran todo correctamente?” Dijo Lyng, una mujer pálida y rechoncha con ojos azul claro. “Tuvo enormes consecuencias para mi vida”.
Estábamos sentados fuera de la casa que ella y su esposo habían comprado recientemente en las afueras de un pequeño pueblo cerca de Copenhague. Hay campos al final de su calle y una escuela justo enfrente de su casa a la que asisten los niños. Lyng fue despedida de su trabajo como ayudante de cocina a finales de 2014, pero sus beneficios por enfermedad y el salario de su marido mantuvieron a flote a la familia. El tiempo extra que tiene para ella y su diagnóstico de SFC también le dieron tranquilidad. A lo largo de los años, había sido diagnosticada con trastorno por déficit de atención, depresión, incluso síndrome bipolar “suave”.
Sin embargo, ella sentía que ninguno de estos diagnósticos explicaba por completo sus problemas. ¿Por qué tendría fiebre y erupciones súbitas que desaparecerían también repentinamente? ¿Por qué su cuerpo dolería algunos días y no otros? ¿Por qué necesitaba descansar durante dos semanas si se ofrecía como voluntaria para planificar el menú para la fiesta de Año Nuevo de su iglesia? El diagnóstico le dio al menos una respuesta.
Los registros de Lyng de Future 2, no mencionaban la fatiga, uno de sus síntomas más debilitantes. Mientras tanto, su médico de familia comenzó a documentar el problema el 20 de marzo de 2003, nueve días después de recibir su tercera y última dosis de Gardasil. En 2004, después de varias pruebas de laboratorio y consultas especializadas que no aportaron información útil, el médico notó que Lyng continuaba teniendo “períodos de dolor de cabeza, fatiga, dolor en articulaciones grandes y pequeñas, falta de concentración y problemas para dormir. Su humor fluctua. No ha habido sospecha de depresión”.
Lyng me dijo que había hablado de sus síntomas con el personal del estudio en cada visita durante el ensayo de cuatro años. (Los sujetos del ensayo se reunieron regularmente con los investigadores durante cuatro años, pero el objetivo de las visitas posteriores era controlar la eficacia de la vacuna, en este caso, si impedía los cambios celulares vinculados al VPH). Incluso les dijo que su enfermedad la había obligado a abandonar la escuela. Pero nadie pareció tomarla en serio: “Siguen diciendo: ‘Este no es el tipo de efectos secundarios que vemos con esta vacuna'”.
Kjærbye-Thygesen, el investigador del ensayo que vio a Lyng, y otro empleado con las iniciales “BW”, presumiblemente una enfermera, sí informaron el dolor de cabeza y en las articulaciones, y también gastroenteritis e influenza, pero no como eventos adversos. En su lugar, usaron la hoja “nuevo historial médico,” que era para que los investigadores enumeraran “Cualquier situación nueva o afecciones concomitantes, alergias a medicamentos y cirugías / procedimientos”. Una nota en los registros, rubricada por Kjærbye-Thygesen, decía que era “difícil” culpar a la vacuna por los dolores articulares de Lyng, sin ofrecer más explicaciones.
A pesar de las instrucciones oximorónicas para enumerar los nuevos síntomas como historia, esto no fue un error. El protocolo del estudio de Merck muestra que en el caso de participantes de fuera de EE UU y el Reino Unido, que fueron la mayoría, solo se informaron los eventos adversos que los investigadores consideraron graves. Otros problemas de salud se registrarían con mucho menos detalle, como nuevo historial médico. (En EE UU y en el Reino Unido, se informaron los eventos graves y no graves).
Merck decidió restringir, en todos los lugares donde se realizó el ensayo, la notificación de eventos adversos – lo que el protocolo del estudio denomina el “seguimiento clínico de la seguridad”- fue solo durante 14 días después de cada una de las tres dosis de Gardasil. Las enfermedades que ocurrieron fuera de estos estrechos intervalos de tiempo se relegaron a una sola línea en la hoja de nueva historia clínica, mientras que, para cada evento adverso, había que hacer varias evaluaciones e informar los resultados. Hubo una excepción: las muertes o los eventos adversos graves, que llamaran la atención del investigador y se consideraran relacionados con la vacuna o con un procedimiento de estudio, debían informarse en cualquier momento. Este diseño puso a los investigadores individuales a cargo de decidir, durante la mayor parte de la duración del ensayo, qué se evaluaría e informaría como posible efecto secundario.
(Future 1 informó eventos adversos no graves para todos, pero se basó en el mismo seguimiento corto que Future 2 y también etiquetó muchos eventos adversos como nuevo historial médico).
Los expertos con los que hablé estaban desconcertados por la forma en que Merck manejó los datos de seguridad en sus ensayos. Según el Dr. Yoon Loke, profesor de la Universidad de East Anglia que estudia los efectos secundarios, dejar que los investigadores juzguen si los eventos adversos deben ser informados “no es un método muy seguro, porque permite que se infiltre el sesgo”. En esencia, esta característica significa que, si el investigador pensaba que la vacuna era segura, tenía menos probabilidades de encontrar posibles efectos secundarios. Sobre el breve periodo de seguimiento, Loke me dijo: “No va a detectar problemas graves a largo plazo, lo cual es una pena”.
Presumiblemente, los reguladores creen que la vacuna es tan segura que no necesitan preocuparse una vez transcurridos los 14 días”.
Un consejero de seguridad de medicamentos de una compañía farmacéutica multinacional me dijo: “Todo lo que sucede desde la primera inyección hasta la última más un período de seguimiento es lo que llamamos eventos adversos emergentes del tratamiento”. Se sorprendió por los breves períodos de seguimiento interrumpidos en los ensayos de Gardasil, así como por la decisión de Merck de que no se informara sobre los eventos adversos no graves de los participantes y que se desestimaran muchos eventos como antecedentes médicos. “Esto es completamente loco”, dijo, y pidió no ser identificada por temor a comprometer su posición en la industria. “Han establecido un protocolo que desde la perspectiva médica y de seguridad parece estar muy mal pensado”.
Según una declaración por correo electrónico de la EMA, “El alcance de la recopilación de eventos adversos en el programa clínico de Gardasil reflejó el estándar de los programas de vacunas de esta compañía”. Agregó, “El seguimiento estándar para las vacunas sin replicación viral [como Gardasil] ha sido 14 días (días 1 a 15) después de cada dosis”.
No hay reglas que dicten la duración exacta del periodo durante el cual se deben informar los eventos adversos en los ensayos de vacunas. Para algunos estudios, se puede medir en días; para otros, se hace desde el principio hasta el final, con todos los eventos registrados de la misma manera, independientemente de su posible vínculo con la vacuna. De hecho, las revisiones de 2005 [4] y 2013 [5] identificaron una variación sorprendente en cómo los investigadores de vacunas recopilan, analizan y presentan los datos de seguridad. Se ha hecho un gran esfuerzo por estandardizarlos [6], y las autoridades de salud están reconociendo cada vez más que algunos efectos secundarios pueden ocurrir tarde. En las pautas publicadas este año [7], la OMS señaló que, aunque la mayoría de los efectos secundarios de la vacuna ocurren en un periodo de dos semanas, podría haber “razones para sospechar que las enfermedades con inicio muchos meses después de la última dosis podrían estar relacionadas con la vacunación previa”.
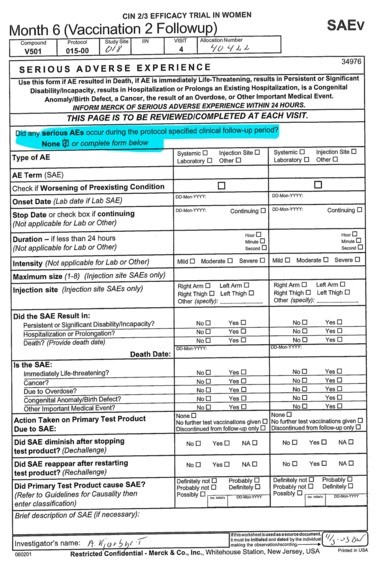
Lyng y yo leímos la definición de “experiencia adversa grave” que aparecía en las hojas que los investigadores tenían que completar durante cada visita después de aplicar la vacuna. Incluía eventos que provocan “incapacidad / discapacidad persistente o significativa”, lo que significa “una afectación importante de la capacidad de una persona para llevar a cabo funciones normales de la vida”. En todos los formularios, la única casilla marcada era la que decía “Ninguna”. ¿Un error? Es discutible, pero podemos decir que no, porque los síntomas de Lyng, según lo registrado por el personal del estudio, comenzaron tres o cuatro semanas después de la segunda dosis, fuera de lo que el protocolo consideraba el seguimiento obligatorio de seguridad.
Un oficial de prensa de la Agencia Danesa de Medicamentos, que aprobó Future 2 en 2002, señaló que el protocolo de estudio de Merck no contenía ninguna mención de “nuevo historial médico” o “nuevos problemas médicos”. En un correo electrónico, escribió: “Tampoco somos conscientes de si esta categoría se haya utilizado en otros ensayos clínicos con medicamentos, ya que según las guías, estos términos no se utilizan”.
Agregó que en su agencia no había habido preocupación por las pruebas de seguridad de Future 2. “Las medidas de seguridad cumplieron con las pautas aplicables a las vacunas”, me dijo, y agregó que el seguimiento de 14 días “está de acuerdo con las directrices científicas de EMA para vacunas”.
Lo que llamó la atención de la Dra. Rebecca Chandler, una expatriada estadounidense que trabaja en Läkemedelsverket, la Agencia Sueca de Productos Médicos, fue una descripción de una niña colombiana de 15 años con problemas neurológicos.
Suecia es el relator de EMA para Gardasil y Gardasil 9, lo que significa que se le asignó la tarea de evaluar las solicitudes de comercialización de las dos vacunas en nombre de la Unión Europea. Como asesor de seguridad clínica en Läkemedelsverket, Chandler había estado investigando informes posteriores a su comercialización procedentes de Dinamarca y Japón que describían dos trastornos neurológicos graves y poco conocidos en niñas y mujeres jóvenes vacunadas con Gardasil. En ambos países, estos casos habían generado grandes debates nacionales que hicieron descender las tasas de vacunación. Cuando llegó la solicitud de Gardasil 9, Chandler decidió analizar los datos del ensayo para ver si encontraba alguna referencia a estas dos afecciones, conocidas como síndrome de taquicardia ortostática postural (STOP) y síndrome de dolor regional complejo (SDRC). Los síndromes se superponen en cierta medida, y también comparten una serie de características con el SFC.
Al principio, no encontró nada; en la solicitud de la compañía no se mencionó ninguna instancia de ninguna enfermedad. Pero los síntomas de la adolescente colombiana, como se describían en los datos del ensayo clínico, le hicieron sospechar POTS, y pidió al fabricante de medicamentos que rastreara su base de datos para ver si había casos similares [8]. Resultó que tres niñas vacunadas con Gardasil 9 habían sido diagnosticadas con el STOP, y una con el SDRC. También hubo varios casos de trastornos neurológicos “de interés”, escribió Chandler en su evaluación de 2014. Pero ninguno de ellos había sido reportado por la compañía como evento adverso; más bien, todos fueron etiquetados bajo nuevo historial médico, de acuerdo con los protocolos de estudio de Merck.
Chandler, que ahora trabaja en el Centro de Monitoreo de Uppsala, una institución líder en investigación de seguridad farmacéutica en Suecia, me dijo que “discutió bastante” sus hallazgos en la agencia, “porque me preocupaba mucho que el diseño del estudio no fuera apropiado para recoger estas cosas. “Al parecer, sus colegas reguladores compartieron su aprensión, exponiendo sus dudas en una serie de informes confidenciales de EMA previos a la aprobación de Gardasil 9. (Obtuve estos informes de Läkemedelsverket a través de varias solicitudes de libertad de información). Un informe confidencial de EMA de 2014 tildo la estrategia de Merck para documentar la seguridad de “procedimiento de estudio poco convencional y subóptimo”; otro observó que el diseño “genera cierto grado de incertidumbre en la evaluación general de seguridad”.
Chandler descubrió que los datos de Merck incrementaban la preocupación sobre una asociación entre la vacuna y el STOP, pero sus colegas de la agencia no le hicieron caso. Más tarde, una revisión impugnada de EMA de 2015 [9] y un estudio de post-comercialización de EE UU [10] tampoco apoyaron la relación.
Los funcionarios que inspeccionaron un ensayo clínico de Gardasil 9 para la EMA también se sintieron obligados a destacar cómo Merck trató el tema de la seguridad, a pesar de considerarlo “un problema sistémico relacionado con el diseño del estudio y no un hallazgo de inspección”. El diseño poco ortodoxo “complicó” el informe de eventos adversos, escribieron los inspectores, en parte porque la información sobre “nuevos eventos médicos” fue “limitada, ya que solo se recolectaron los síntomas y no se realizaron más evaluaciones médicas y no se registró ningún resultado”.
En su informe final recomendando la aprobación condicional de Gardasil 9, los relatores EMA pidieron al fabricante de medicamentos que [11] “discutiera el impacto de [su] método no convencional y potencialmente subóptimo de informar los eventos adversos y proporcionara evidencia sobre la integridad general y precisión de los datos de seguridad provistos en la solicitud.” Läkemedelsverket se negó a compartir la respuesta de la compañía. En la evaluación pública de EMA de Gardasil 9, toda mención a las preocupaciones de seguridad ha sido eliminada [12].
En respuesta a mis preguntas, la EMA señaló que sus expertos, en una evaluación de 2006que está disponible al público de la vacuna Gardasil original, encontraron que la forma de Merck de evaluar la seguridad era “establecida y apropiada”. Pero la agencia no explicó cómo esa opinión se ajusta a sus reservas no publicadas sobre la investigación de Gardasil 9, que manejó la seguridad esencialmente de la misma manera.
La Dra. Susanne Krüger Kjær, profesora de epidemiología del cáncer ginecológico en la Universidad de Copenhague, que supervisó la parte danesa de Future 2, se abstuvo de abordar los problemas de seguridad. “No puedo responder ninguna de esas preguntas porque no diseñé el ensayo”, me dijo. Ella es una de las autoras en la publicación científica principal del ensayo, que apareció en 2007 en el New England Journal of Medicine [13] y no menciona nada sobre nuevo historial médico.
En su declaración, Merck dijo que usar la categoría de “nuevo historial médico” permitió guardar una amplia colección de posibles eventos de seguridad, incluyendo nuevos problemas, síntomas y pruebas de laboratorio o de imágenes, lo que permite hacer una evaluación integral de la seguridad. Citó un estudio de 2010 [14] que analizó los datos informados como nuevo historial médico y se encontraron tasas “comparables” en los participantes del ensayo que recibieron la vacuna y el placebo, respectivamente.
En un día lluvioso de septiembre, volé con Lyng a Berlín para visitar a Gerd Wallukat, un científico de la empresa de biotecnología Berlin Cures. Wallukat, un hombre corpulento de alrededor de 70 años ha sido pionero en la investigación de una clase especial de autoanticuerpos, proteínas fabricadas por el sistema inmune que atacan las propias células del cuerpo en lugar de a los invasores extraños como los virus o bacterias. Los investigadores han encontrado estos “autoanticuerpos agonísticos” en personas con diferentes enfermedades, como el SFC, el SPOT y el SDRC, pero su función no se comprende del todo. Berlin Cures se encuentra haciendo ensayos, en etapas tempranas, para ver si neutralizarlos podría tener un efecto terapéutico.
Uno de los médicos de Lyng en Dinamarca había estado trabajando con Wallukat para identificar autoanticuerpos en niñas y mujeres que enfermaron después de la vacuna Gardasil. Sus hallazgos preliminares no publicados sugirieron que casi todas estas mujeres albergan uno o más autoanticuerpos agonísticos, y Wallukat se ofreció a estudiar si Lyng los tiene. En el avión, estaba nerviosa y muy habladora. Ella no quería estar enferma, explicó, pero era agotador tener que convencer a las personas que la rodeaban -su trabajadora social, su familia, incluso su esposo- de que estaba físicamente enferma, mientras una prueba tras otra daba negativo. Le asusataba la idea de recibir otro resultado negativo.
No fue así. “Tienes beta-2, nociceptina, muscarínico”, le dijo Wallukat, refiriéndose a tres tipos de autoanticuerpos, “el patrón clásico que he visto en pacientes después de la vacunación”. Desde una cafetería, Lyng llamó a su esposo. “Estoy completamente abrumada. Es la primera vez que tengo un resultado positivo”, le dijo. “Esto significa que no está solo en mi cabeza, todos esos médicos que me preguntaron si podría ser psicológico”.
Pero la prueba positiva de Lyng desencadena más preguntas que las que responde: ¿qué indujo a estos autoanticuerpos y cómo? ¿Causaron sus síntomas, como especuló su médico? ¿Y neutralizarlos produciría mejoras, como apuntó Berlin Cures? La prueba aportó otra pieza al rompecabezas del caso de Lyng; pero como sucede tan a menudo en la ciencia, no aportó certeza, y no probó nada sobre la causalidad. Si resulta que Gardasil tiene graves efectos secundarios, es evidente que deben ser poco comunes. Además, la vacuna aún podría valer la pena a pesar de ese riesgo hipotético: el cáncer de cuello uterino, aunque poco común, es una enfermedad terrible.
Si hay una lección clara de la experiencia de Lyng, es que la ciencia es un proceso. Tomando prestadas las palabras del psicólogo estadounidense Brian Nosek, “La ciencia no trata de lo verdadero y lo falso, se trata de reducir la incertidumbre”. No reconocer esa incertidumbre, cuando es legítima, probablemente solo desacelerará el progreso científico. En el controvertido reino de las vacunas, también alimentara a los teóricos de la conspiración que divulgan miedos exagerados o infundados entre un público ya desconfiado.
Una forma de responder a las preocupaciones del público es reconocer los límites de lo que ha aportado la investigación actual y dar la bienvenida al debate sobre lo que sabemos y lo que no sabemos, según Lemmens, el bioéticista.
“La transparencia y el debate abierto sobre los efectos secundarios son esenciales para salvaguardar la confianza en la provisión de medicamentos y la planificación de la salud pública”, me dijo. En cambio, a medida que la confianza en Gardasil cayó en picado en Dinamarca, los reguladores duplicaron el mensaje simplista de que la vacuna ha sido probada exhaustivamente y es incuestionablemente segura.
En una conferencia de prensa en mayo, el Dr. Søren Brostrøm, director general de la Autoridad de Salud de Dinamarca y ginoco-obstetra, dijo a los periodistas que “para nosotros, como autoridades, no hay dudas acerca de la eficacia y seguridad de esta vacuna”. Esto parece contradecir las propias deliberaciones de la EMA sobre la forma en que Merck informó los datos de seguridad en sus ensayos. Como el Dr. Christian Gluud, que dirige la Unidad de Ensayos de Copenhague, un centro de investigación en el Hospital Universitario de Copenhague, me dijo recientemente: “Si hubiésemos probado nuestras vacunas adecuadamente, no tendríamos la discusión que estamos teniendo ahora”.
Referencias