Ocho meses después de dejar su cargo al frente de la autoridad sanitaria de Australia (TGA), John Skerritt ha sido nombrado miembro del consejo de Medicines Australia, el grupo más fuerte que representa a la industria farmacéutica del país.
En una entrevista reciente con Medical Republic, Skerritt habló de su nuevo cargo como director independiente en su consejo directivo, afirmando que estaba “deseando trabajar estrechamente con la industria” [1].
Reflexionando sobre su tiempo en la TGA, Skerritt dijo que de lo que estaba más orgulloso era de la forma en que fue capaz de “rehacer totalmente” el marco regulatorio, acelerando la aprobación de medicamentos.
“Ahora tenemos vías prioritarias, provisionales y de otro tipo que permiten que los medicamentos lleguen mucho antes a los pacientes”, dijo Skerritt.
Desde que dejó la TGA, Skerritt también afirmó que estaba “trabajando muchísimo en crear la estrategia para el ARN mensajero en Australia, tanto en el área terapéutica como en las vacunas”, el mismo sector que fue responsable de regular durante la pandemia.
Esto ha reavivado las preocupaciones sobre el fenómeno de la “puerta giratoria” de los reguladores de medicamentos, por la que los funcionarios de la agencia acaban trabajando para (o asesorando a) las mismas industrias que una vez regularon.
Se solicitó la opinión de la TGA. En un comunicado, la agencia dijo que “no aplica restricciones al tipo de empleo que sus empleados pueden aceptar cuando dejan el departamento”.
Por otra parte, solicité a Medicines Australia la declaración de conflictos de Skerritt (que los miembros de la junta normalmente están obligados a presentar) pero no respondieron, y no se considera que el público deba saber si Skerritt tiene un interés financiero en la tecnología de ARNm.
Tony Nikolic, director del bufete de abogados Ashley, Francina, Leonard & Associates, afirmó que, independientemente de que Skerritt reciba o no una remuneración por su nuevo cargo, sigue estando en condiciones de influir en las decisiones normativas y políticas.
“Medicines Australia sigue siendo un grupo de presión y puede influir en las decisiones de la TGA y del comité asesor técnico sobre vacunas (Australian Technical Advisory Group on Immunisation o ATAGI) para favorecer determinadas investigaciones. En este caso, Skerritt admite que está interesado en impulsar la tecnología del ARNm”, afirma Nikolic.
Según él, algunas organizaciones australianas han abogado por mejorar las normas para evitar la “puerta giratoria” y garantizar que los funcionarios públicos actúen con integridad, imponiendo un periodo de “enfriamiento” una vez dejan el cargo público.
“Debería hacerse mayor hincapié en garantizar que haya un periodo de reflexión no inferior a 5 años entre nombramientos”, dijo Nikolic. “Las recientes declaraciones de Skerritt no hacen sino subrayar la necesidad de una supervisión legislativa y reglamentaria adecuada para gestionar y prevenir posibles abusos y conflictos de intereses.”
Peter Doshi, profesor de la Facultad de Farmacia de la Universidad de Maryland, dijo que las vías aceleradas para la aprobación de medicamentos que mencionó Skerritt, tienen un costo.
“La rapidez de las autorizaciones es un buen objetivo, pero no se deben sacrificar los estándares. “EE.UU. tiene ya más de dos décadas de experiencia en acelerar la comercialización de medicamentos, y los costos de las prisas son considerables”.
“Los funcionarios suelen argumentar que no recortan etapas, pero sabemos que acelerar la aprobación de fármacos significa que éstos pueden llegar al mercado sin pruebas sustanciales de que mejoran los resultados de los pacientes”, añadió Doshi.
“Y las investigaciones demuestran que es más probable que esos fármacos se etiqueten posteriormente con advertencias de seguridad adicionales y se retiren del mercado debido a problemas de seguridad”.
La reciente investigación de Doshi para The BMJ puso de relieve el actual problema de la “puerta giratoria” de las agencias reguladoras [2].
Doshi informó de que dos altos funcionarios de la FDA, que supervisaron la aprobación de la vacuna “Spikevax” covid-19 de Moderna, aceptaron puestos en Moderna a los pocos meses de dejar la agencia.
“El servicio público no es un trabajo cualquiera: el público te confía en que respondas al interés público. Las idas y venidas entre la FDA y la industria violan esa confianza. Despierta sospechas, sospechas que bien podrían ser válidas”, afirmó Doshi.
“¿Cómo se puede estar seguro de que las decisiones que se toman en el sector público son realmente de interés público? Si un funcionario de la FDA aspira a un lucrativo puesto en la industria, ¿hasta qué punto va a ser duro con su posible futuro empleador? El público necesita un regulador en el que pueda confiar y que tome siempre decisiones reguladoras pensando en el interés público, no en el interés privado de alguien”, añadió.
Algunos han argumentado que la puerta giratoria puede ser un activo que aprovecha la experiencia y los conocimientos únicos, pero Doshi dijo que este argumento es erróneo y difumina la línea entre experiencia y compromiso.
“La experiencia está muy bien. Pero es posible que un experto que trabaje como funcionario público no tenga un compromiso con el interés público y esté pensando también en su beneficio personal, o en ayudar a su red de contactos. Por eso algunos proponen un periodo de ‘enfriamiento’ antes de permitir que el personal acepte funciones en las industrias que antes regulaba”, dijo Doshi.
TGA bajo la lupa
Durante las audiencias del Senado, se criticó a los miembros del personal de la TGA por restar importancia a los problemas de seguridad relacionados con las vacunas de ARNm y por no controlar los efectos adversos.
En una comparecencia ante el Senado el 3 de agosto de 2023, el senador por Australia Meridional Alex Antic preguntó a la TGA sobre su modelo de operaciones con conflictos de interés financieros.
Antic citó mi investigación del BMJ, que informaba de que la TGA tenía la mayor proporción de su presupuesto financiado por la industria farmacéutica (96%) en comparación con otros cinco reguladores internacionales.
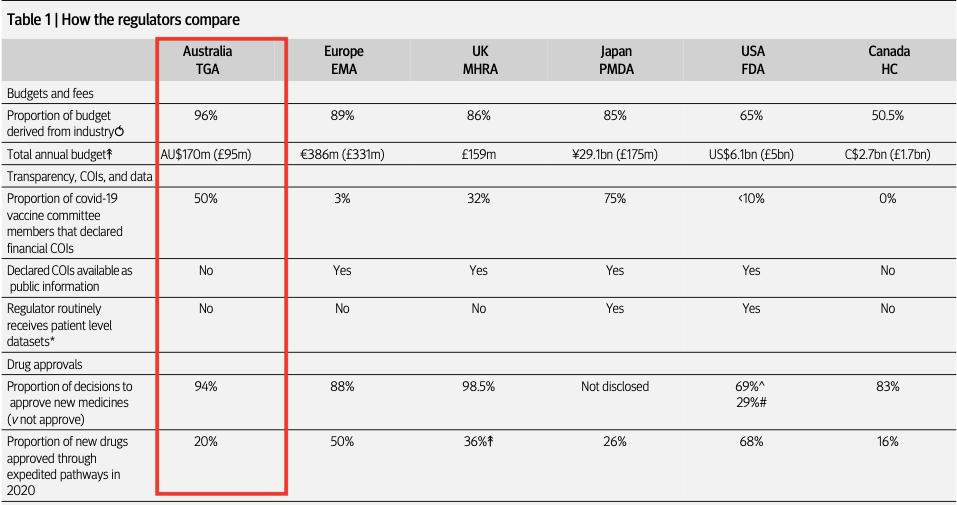
“¿Acepta la TGA que está muy comprometida en virtud de estar financiada por la industria?”, preguntó el senador Antic.
“No”, respondió bruscamente la TGA.
En virtud de la Ley de Productos Terapéuticos de 1989, la TGA dijo que no había obligación de revelar los nombres de las personas implicadas en el proceso de aprobación de la vacuna covid-19, ni ninguno de sus empleados consintió en que se revelaran sus nombres.
En un comunicado, la TGA dijo:
“El personal ha recibido amenazas (incluidas varias docenas de amenazas de muerte) de personas que se oponen a la vacunación y, en particular, a la vacunación con las vacunas covid-19″. En estas circunstancias, y teniendo en cuenta las obligaciones de seguridad del Gobierno australiano para con su personal, es inapropiado hacer públicos los nombres de las personas implicadas en el proceso de aprobación de la vacuna covid-19.”
La agencia dijo que podía presentar una solicitud de libertad de información, pero que las autoridades probablemente considerarían la información como “exenta teniendo en cuenta las obligaciones de seguridad en torno al personal del Gobierno y otros factores de interés público.”
Referencias