Genéricos
Medicines for Europe espera que se lancen 50 nuevos biosimilares al mercado hasta 2020
Marta Riesgo
El Global, 6 de mayo de 2016
http://www.elglobal.net/noticias-medicamento/2016-05-06/industria-farmaceutica/medicines-for-europe-espera-que-se-lancen-50-nuevos-biosimilares-al-mercado-hasta-2020/pagina.aspx?idart=979986&utm_source=mail&utm_medium=newsletter&utm_campaign=elglobal
La patronal europea celebra los diez años de la llegada de estos medicamentos a la Unión Europea
El pasado 12 de marzo se cumplieron 10 años de la aprobación del primer biosimilar en la Unión Europea. Se trataba de la hormona de crecimiento Omnitrope (Somatropin), de Sandoz, cuyo biológico de referencia era Genotropin, de Pfizer. Desde entonces hasta hoy son ya 20 los biosimilares disponibles en la Unión Europea. Pero aún queda mucho camino por recorrer y se espera que los próximos años sean claves en el lanzamiento de nuevos biosimilares al mercado. Así lo considera la patronal Medicines for Europe que, en el libro blanco Delivering on the Potential of Biosimilar Medicines: the Role of Functioning Competitive Markets, publicado recientemente, apunta al lanzamiento de más de 50 nuevos biosimilares hasta 2020.
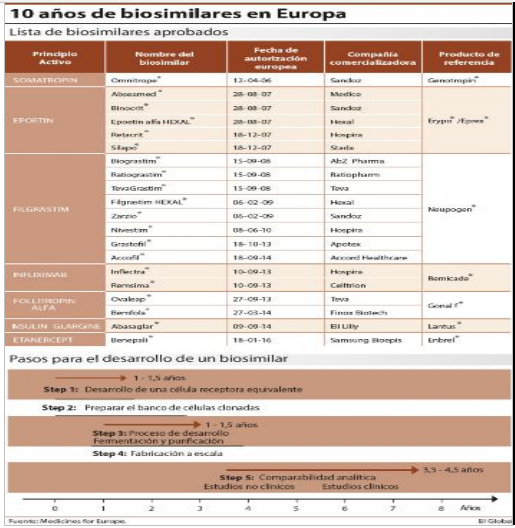
No obstante, para que estos productos puedan mejorar el acceso y la sostenibilidad de los sistemas sanitarios, la patronal llama a la adopción de medidas concretas que potencien su uso en Europa. Es necesario que las agencias europeas muestren una postura clara en términos de intercambiabilidad, así como que se facilite una mayor información para pacientes y médicos sobre los beneficios de estos medicamentos. Además, Medicines for Europe solicita una política de incentivos para que se potencie el uso de biosimilares.
Desde su introducción en la Unión Europea los medicacmentos biosimilares han conseguido aumentar el acceso de los pacientes en un 44% en los cinco principales países de la UE, según el informe. “Los medicamentos biosimilares tienen el potencial de aumentar drásticamente el acceso del paciente y generar un ahorro para los sistemas de salud”, aseguró Carol Lynch, directora de productos biofarmacéuticos de Sandoz y presidenta del Grupo de medicamentos biosimilares de la patronal europea durante el 14 Congreso del Grupo de medicamentos biosimilares celebrada en Londres. “El Grupo se dedica a fomentar el diálogo entre los agentes implicados en el sector como medio esencial para mejorar la confianza de las partes interesadas, así como la comprensión y la aceptación de estos medicamentos, un factor crítico para asegurar la absorción de estos productos”, puntualizó.
Por su parte, Jacek Glinka, presidente de Medicines for Europe, destacó que la industria está dispuesta a trabajar con los estados miembros para aumentar el acceso del paciente a estos tratamientos y reducir las desigualdades de acceso en toda Europa. Glinka pidió además a todos los países que aprovechen al máximo la introducción de los medicamentos biosimilares y que diseñen políticas destinadas a reducir las disparidades en el acceso. “Europa ha sido líder y una inspiración en el establecimiento del marco científico y tenemos que mantener este liderazgo con la adopción de políticas que favorezcan un acceso sostenible”.
Tal y como asegura el libro blanco publicado por Medicines for Europe, en Europa 7 de los 10 medicamentos más vendidos en 2014 fueron biológicos lo que muestra, dice, el impacto que suponen para los sistemas sanitarios europeos.
Intercambiabilidad
Por otro lado, la patronal incluye en el informe su posición sobre la posible intercambiabilidad de los biosimilares con sus biológicos de referencia. En este sentido, explica que si una empresa originaria cambia el proceso de fabricación de un producto existente, la intercambiabilidad entre los productos anteriores y posteriores se acepta siempre y cuando se admitan los datos de la revisión de comparabilidad del producto anterior y posterior. De este modo, consideran que debería aplicarse el mismo enfoque para los biosimilares y que la intercambiabilidad debe basarse en los datos de comparabilidad con el producto de referencia.
Desde su punto de vista, los extensos datos de comparabilidad, junto a los realizados después de la comercialización demuestran que es seguro y eficaz cambiar las dosis del biosimilar con el producto biológico de referencia. En este sentido, esperan que las agencias regulatorias de Europa muestren una postura clara en este sentido.
Potencial de mercado
Recientemente la consultora IMS Health publicaba un informe que mostraba el potencial de estos fármacos en el mercado norteamericano y los cinco mercados europeos más importantes (Alemania, Francia, Italia, Reino Unido y España). Este aseguraba que si el precio de los biosimilares fuese un 40% más barato que sus biológicos de referencia, estos proporcionarían un ahorro total de 9€8.000 millones hasta 2020. De l mismo modo, si el descuento en el precio fuese de un 30%, el ahorro se reduciría a 7€4.000 millones y bajaría hasta los €49.000 millones con un precio un 20%.
Según el citado informe, alrededor de 80 nuevos fármacos biológicos fueron lanzados al mercado durante la pasada década para diferentes áreas terapéuticas. En 2002 el mercado de biológicos a nivel global alcanzó los US$46.000 millones y se espera que para 2020 este supere los US$390.000 millones, lo que muestra, apunta la consultora, el potencial de este sector. Estos medicamentos, dicen, incrementarán el valor del mercado farmacéutico global por encima del 28% lo que representa un reto para los pagadores de los sistemas sanitarios mundiales.
En este contexto la llegada de los biosimilares al mercado abre grandes posibilidades tanto para administraciones como para pacientes o profesionales, ofreciendo mejoras en el acceso a fármacos seguros y eficaces.
No obstante, para aprovechar esta oportunidad, el informe apunta a la necesidad de que los pagadores apoyen medidas que impulsen la entrada de los biosimilares a los mercados, como puede ser una mayor información dirigida a profesionales y pacientes sobre estos fármacos.
El tamaño actual del mercado de los productos biológicos que pierden la patente hasta 2020 es muy significativo, tal y como muestra el informe de la consultora internacional. En este sentido, el valor hasta septiembre de 2015 de los ocho biológicos más vendidos en EE UU y en los cinco principales mercados de la UE supera los €42.000 millones.