¿Recuerda el pánico en 2020 [1] cuando se supo que la vacuna anticovídica de ARNm de Pfizer no se podía transportar por el país a menos que se almacenara a temperaturas muy bajas?
Pfizer afirmó que el ARNm en la vacuna —que codificaba la proteína de punta— era inestable y se degradaría si los viales cerrados no se conservaban a una temperatura de -70 °C.
Por lo tanto, cuando la FDA otorgó el permiso de comercialización [2] en diciembre de 2020, especificó que la vacuna se debería almacenar entre -80 °C y -60 °C, por lo que era necesario usar congeladores muy potentes, un desafío para las regiones con recursos limitados.
Sin embargo, en febrero de 2021 parecía que Pfizer había resuelto el problema.
Envió nuevos “datos de la estabilidad del ARN” a la FDA que demostraban que la vacuna se podía almacenar en congeladores convencionales (-20 °C) y que ya no era necesario usar congeladores más potentes.
La FDA aprobó [3] esa modificación con prontitud.
Dos meses después, la Administración de Bienes Terapéuticos de Australia (TGA, por sus siglas en inglés) también aprobó [4] la solicitud de Pfizer y permitió que los viales cerrados se conservaran a una temperatura de -20 °C hasta dos semanas.
La temperatura de almacenamiento no fue el único cambio. Los reguladores de medicamentos también aprobaron la extensión de la fecha de vencimiento. Por ejemplo, extendieron las fechas de vencimiento de varios lotes de la vacuna de Pfizer un año (FDA) [5] o seis meses (TGA) [6].
Pero dada la susceptibilidad del ARN a los cambios de temperatura y la duración del almacenamiento, ¿qué datos de estabilidad usaron los reguladores para tomar la decisión de permitir estos cambios?
Un choque contra una pared de ladrillos
Pregunté a la FDA sobre los “datos de estabilidad del ARN” que recibieron de Pfizer, pero la Agencia respondió que no proporcionarían esa información.
En su lugar, me indicaron que enviara una solicitud de Libertad de la Información (FOI).
Respondí a la FDA que su proceso de FOI estaba estancado y que ya había enviado una solicitud de FOI hacía seis meses que estaba siendo “procesada”, pero sin resultados.
De la misma manera, solicité los datos a la TGA, pero la Agencia afirmó que “la TGA no puede proporcionar esa información directamente ya que los patrocinadores la consideran confidencial desde el punto de vista comercial”.
¿Y Pfizer? Recibí la misma respuesta. La empresa se negó a revelar los datos: afirmaron que era “confidencial desde el punto de vista comercial”.
Phillip Altman tiene más de 40 años de experiencia en ensayos clínicos y asuntos regulatorios, y afirma que los datos de la estabilidad del ARN revisten un gran interés público y se deberían divulgar.
“Es de suma importancia conocer los datos de estabilidad del ARN en las vacunas, ya que si el ARN se desintegra, la eficacia de la vacuna disminuye”, afirma Altman.
“Pero, me preocupa más la seguridad, porque algunas personas recibirán dosis más altas de ARNm: esto podría explicar por qué algunos lotes de la vacuna se asocian a más efectos adversos que otros”, añade.
Altman señala un análisis danés publicado [7] en la European Journal of Clinical Investigation [Revista Europea de Investigación Clínica] que descubrió que los eventos adversos graves se asociaban a lotes específicos de la vacuna contra la covid-19 de Pfizer (vea el gráfico).
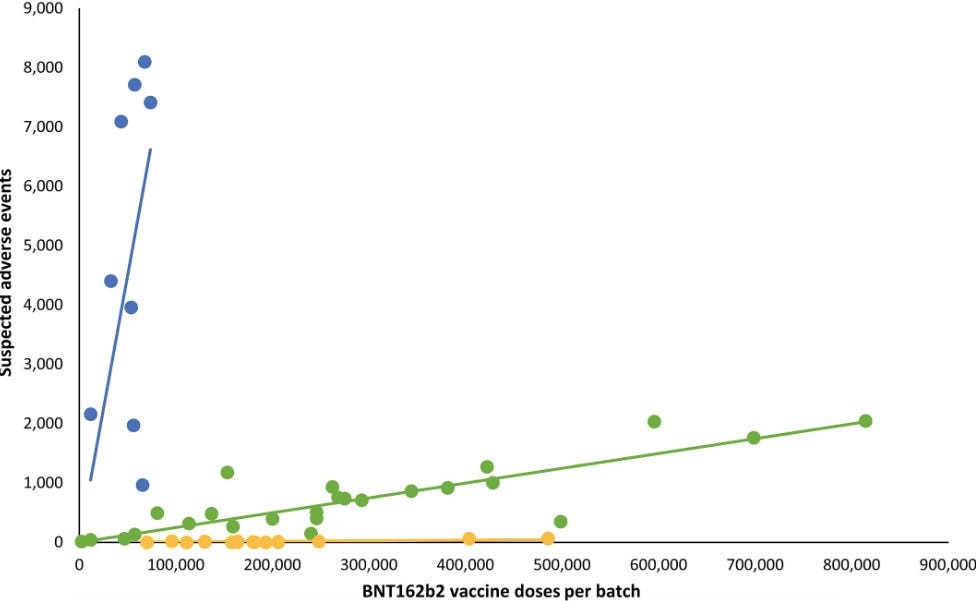
Número de eventos adversos sospechosos (SAE) después de la vacunación con ARNm BNT612b2 en Dinamarca (27 de diciembre de 2020-11 de enero de 2022) según el número de dosis por lote de vacunas. Cada punto representa un único lote de vacunas. Las tendencias son líneas de regresión lineal.
El doctor David Wiseman, un biocientífico investigador que participó en el desarrollo de productos médicos, afirmó que no deberíamos preocuparnos solo por el “ARN intacto”.
“Necesitamos información sobre las porciones de ARN que no están intactas”, dice Wiseman. “Es posible que los fragmentos pequeños de ARNm también tengan efectos biológicos, como inflamación o el control del funcionamiento de otros ARN”.
Wiseman asegura que no es la primera vez que los reguladores toman una decisión que podría impactar la estabilidad del ARN: se refiere a que la FDA aprobó que se modificara la solución amortiguadora que se usa en la vacuna de ARNm de Pfizer y afirmó que “mejoraba el perfil de estabilidad de la vacuna”.
“Si la nueva solución ayudara a estabilizar el ARNm, entonces probablemente afectaría la cantidad de proteína de punta que se produce o modificaría la forma en la que las nanopartículas lipídicas se comportan en el organismo. Pero ¿dónde estaban los datos cuando la FDA tomó esa decisión? La FDA nunca insistió en que la nueva formulación se probara en animales antes de inyectarla a los niños”, afirma Wiseman.
En octubre de 2021, le hizo notar este punto al CDC. Desde entonces, Moderna ha publicado investigaciones que demuestran cómo el cambio de la solución amortiguadora no solo modifica el funcionamiento del ARNm, sino que también influye sobre la estabilidad del ARN.
Dados los problemas de estabilidad que ya se conocen, Wiseman afirma que habría sido esencial realizar pruebas de estabilidad en condiciones del mundo real para evaluar la integridad del ARN y las nanopartículas lipídicas después del transporte, la conservación y la preparación, y el almacenamiento en clínicas en condiciones que no son ideales.
“Es momento de que los reguladores restauren la confianza del público y publiquen este tipo de datos. Hasta entonces, ¿por qué inyectaríamos a cualquiera —especialmente a los niños— una vacuna sin divulgar estos y otros tipos de datos?”, afirma Wiseman.
Referencias