Investigaciones
La Comisión Europea publica las recomendaciones del panel de expertos sobre los altos precios de los medicamentos
(European Commission publishes expert panel’s recommendations on high drug prices)
Ellen ‘t Hoen
Medicines, Law, and Policy 20 de febrero de 2018
https://medicineslawandpolicy.org/2018/02/european-commission-publishes-expert-panels-recommendations-on-high-drug-prices/
Traducido por Salud y Fármacos
Este mes, la Comisión Europea publicó un documento sobre nuevos modelos para pagar los medicamentos innovadores de alto costo, un informe del Panel de expertos sobre formas efectivas de invertir en salud (EXPH) [1].
El informe analiza alternativas para el pago de los medicamentos nuevos y costosos, como estrategia para encontrar soluciones al creciente precio de los nuevos productos farmacéuticos. El panel que no rehúye explorar temas clave como la necesidad de mayor transparencia en la forma de establecer los precios de los medicamentos, la I + D y los costos de marketing, insta a las autoridades que regulan la competencia a investigar cómo se establecen los precios de los medicamentos, el incremento en la proporción de medicamentos nuevos que reciben la designación de ‘huérfanos’, invita a revisar el sistema de patentes y la exclusividad del mercado como piedras angulares para la innovación, a desarrollar alternativas para financiar la innovación utilizando los principios de la desconexión o desvinculación [2] tales como la adjudicación de premios, y a plantearse la pregunta de cómo garantizar el “rendimiento público de la inversión pública”. Además, explora formas de reforzar el poder de negociación de los gobiernos en las negociaciones de precios, incluso mediante el uso de licencias obligatorias para patentes de medicamentos.
El panel recomienda cambiar las reglas que rigen la forma en que se desarrollan y comercializan los medicamentos, incluyendo las normas de financiación de la Agencia Europea de Medicamentos (EMA). El panel quiere que la EMA esté menos comprometida con la industria y sugiere que el trabajo de la EMA se pague con fondos públicos. En este momento, el presupuesto operacional de la EMA depende en gran medida de las cuotas que paga la industria por sus servicios. Una mayor independencia puede ayudar a la agencia a elevar sus estándares cuando analiza nuevos productos. Según el Panel, la baja proporción de medicamentos nuevos que aportan importantes beneficios clínicos contrasta con el impulso de la EMA para acelerar su comercialización. Los estudios realizados por el Instituto para la Calidad y la Eficiencia en la Atención de la Salud (Insitute for Quality and Efficiency in Health Care) muestran que, en general, el 57% de los medicamentos nuevos no aportan beneficios adicionales. (Figura 1.)
Los temas que el panel considera más importantes y que deben tenerse en consideración en el nuevo modelo de pago son:
El Panel reconoce que un solo modelo de pago no podrá abordar todos estos problemas. Pero las políticas actualmente disponibles no son suficientes para formular respuestas efectivas. Para desarrollar estrategias nuevas que promuevan la innovación y nuevos modelos de pago se requiere mayor transparencia y participación de la población.
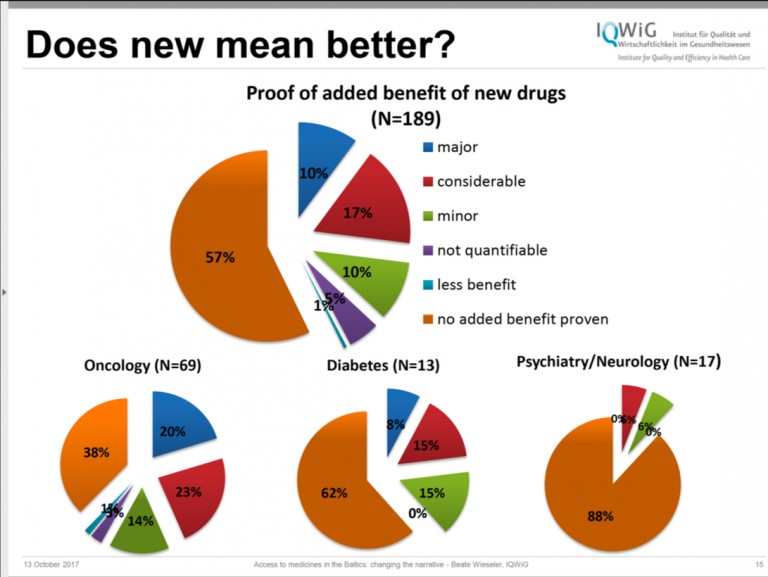
Nota: Does new mean better= ¿Nuevo equivale a mejor? Proof of added benefit of new drugs = Prueba del beneficio adicional de los medicamentos nuevos. major=importante; considerable= considerable; minor= poco; not quantifiable= no cuantificable; less benefit= menos beneficios; no added benefit proven = no hay evidencia de que aporte beneficios adicionales.
El Panel, hasta cierto punto, lo reconoce. Solicita que haya un mayor intercambio de información y diálogo entre los interesados y que se establezcan plataformas para facilitar dicho diálogo. Pero no está claro por qué el Panel solo permite la participación de los gobiernos y la industria en dichas plataformas de diálogo.
Muchas de las recomendaciones discutidas en el informe del Panel no son nuevas. Figuran también entre las recomendaciones del Panel de Alto Nivel de la ONU sobre Acceso a Medicamentos e Innovación [3] y de la Comisión Lancet sobre Políticas de Medicamentos Esenciales [4], así como en numerosos informes [5] de la OMS y organismos nacionales (Véase, por ejemplo, el informe del Consejo de Salud holandés sobre innovación y acceso [6]. Se espera que el proyecto de la OCDE sobre acceso sostenible a terapias innovadoras publique sus recomendaciones en cualquier momento. Aunque se rumorea que las recomendaciones pueden verse diluidas por las presiones de los grupos con intereses creados. Aquí está nuestra contribución a la consulta de la OCDE [7].)
Lo que convierte a este informe de expertos en algo especial es que se ha publicado en un momento en que, en Europa, la necesidad de abordar los elevados precios de los medicamentos ha alcanzado niveles de emergencia. Todavía no tenemos una estrategia europea para abordar los elevados precios de los medicamentos, pero los Estados miembros están cooperando cada vez más para encontrar la forma de responder a los precios que impone la industria farmacéutica. En la Unión Europea (UE) hay un consenso amplio en que abordar los precios exige revisar la forma en que pagamos por la innovación. En junio de 2016, la Comisión Europea, tal como establecieron las Conclusiones del Consejo sobre el fortalecimiento del equilibrio en los sistemas farmacéuticos en la UE y sus Estados miembros [8], está revisando los incentivos para promover la innovación farmacéutica que afectan la fijación de los precios de los medicamentos. Los resultados de ese trabajo deberían publicarse pronto. El informe del panel de expertos debería ser una contribución importante a la formulación de políticas europeas.
La industria tildó a un borrador previo del informe, en un comentario de 48 páginas [9] publicado por EFPIA en diciembre del año pasado, de “oportunidad perdida para mejorar el impacto en los pacientes y apoyar la sostenibilidad de nuestros sistemas de salud”. La respuesta de EFPIA, que aparentemente retrasó la publicación del informe, no alteró significativamente su contenido.
Aquí hay un resumen de las recomendaciones tomadas del informe:
Referencias