Gestión de los Ensayos Clínicos, Metodología, Costos y Conflictos de Interés
Repensar los ensayos clínicos para medicamentos contra el cáncer de próxima generación (Rethinking clinical trials for next-generation cancer drugs)
Stephen Ornes
Knowledge Magazine, 21 de febrero de 2020
https://www.knowablemagazine.org/article/health-disease/2020/next-generation-cancer-drugs-clinical-trials
Traducido por Salud y Fármacos
Las terapias adaptadas a los marcadores genéticos de un tumor son prometedoras, pero descubrir quién tiene más probabilidades de beneficiarse presenta nuevos desafíos para los científicos.
Los tratamientos contra el cáncer siempre se han relacionado con una parte específica del cuerpo: estos medicamentos para el cáncer de seno y aquellos para el cáncer de pulmón. O al menos así solían ser.
La situación cambió en mayo de 2017, cuando la FDA emitió su primera aprobación para un medicamento contra el cáncer que es “independiente del sitio”. El medicamento, Keytruda, había sido aprobado previamente para el melanoma avanzado y algunos otros tipos de cáncer. Pero la nueva aprobación fue notable porque significaba que cualquier persona con un biomarcador genético específico, sin importar el sitio inicial del cáncer, puede usar el medicamento.
Tomar decisiones de tratamiento basadas en las variaciones genéticas de un tumor es un cambio histórico en la forma de abordar el cáncer. Ese cambio ha obligado a los investigadores a repensar la forma de estudiar los tratamientos nuevos. La aprobación de Keytruda fue una de las primeras en seguir un tipo de ensayo clínico emergente, llamado ensayo de canasta, que evalúa un medicamento que tiene un objetivo molecular específico en muchos tipos diferentes de cáncer. Estos ensayos agrupan a los pacientes en “cestas” según el lugar donde se encuentren sus tumores, por lo que un solo ensayo podría incluir una cesta para el cáncer de pulmón, otra para el cáncer de tiroides y una tercers para el cáncer de mama.
Los ensayos de canasta son uno de los primeros diseños que se han adaptado para probar la idea de usar perfiles genéticos para emparejar a los pacientes con los medicamentos que tienen mayor probabilidad de ayudarlos. En el proceso, estos ensayos han contribuido a responder preguntas sobre cómo las mutaciones genéticas raras contribuyen al cáncer, dice el oncólogo Gary Doherty en los Hospitales de la Universidad de Cambridge en el Reino Unido.
Aunque la visión de la terapia dirigida contra el cáncer se ha mantenido en gran medida fuera del alcance [1], un número creciente de investigadores considera que los ensayos de canasta son una forma de mejorar las probabilidades de éxito. Algunos de los primeros ensayos canasta han aportado tratamientos importantes, como Keytruda, para algunos pacientes. Otros no han logrado convertirse en nuevos tratamientos, pero Doherty y otros dicen que incluso esos ensayos han reforzado nuestro conocimiento sobre la sorprendente complejidad del cáncer, enfatizando la diversidad de sus bases moleculares y su obstinada resistencia al tratamiento.
Nuevos tipos de ensayos
Hay más de 700 mutaciones genéticas que se relacionan con la aparición o el crecimiento del cáncer. En cualquier tumor, cuatro o cinco, estas variaciones genéticas pueden llevarlo por el mal camino. Algunas mutaciones impulsan el crecimiento de un tumor; otras paralizan las defensas naturales del cuerpo. Podría haber millones de combinaciones de mutaciones, posiblemente miles de millones, detrás del desarrollo de un cáncer. Esa complejidad puede ayudar a explicar por qué las tasas de supervivencia de las personas con muchos tipos de cánceres avanzados apenas han cambiado en los últimos 50 años. Pero al mismo tiempo, esos cientos de genes ofrecen una solución tentadora: más oportunidades para que los medicamentos dirigidos se concentren en las vulnerabilidades del tumor de un paciente.
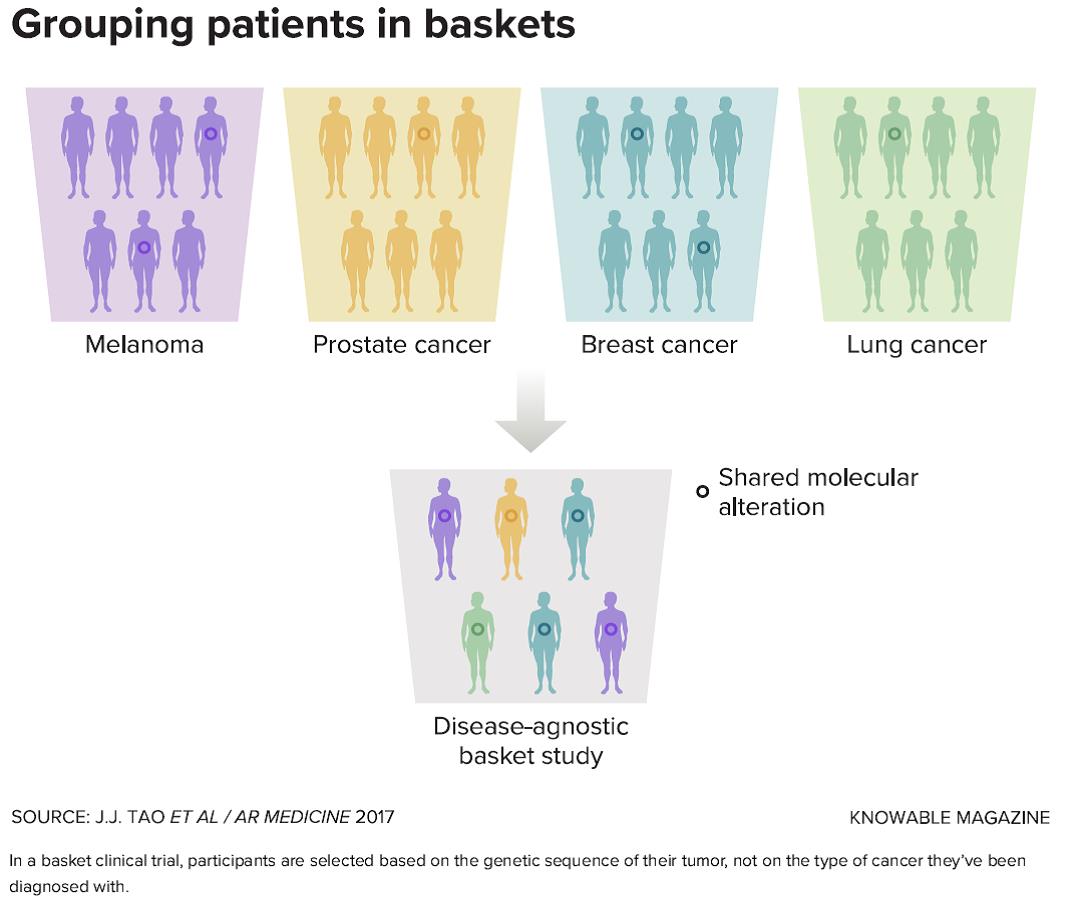
En un ensayo clínico tipo canasta, los participantes se seleccionan según la secuencia genética de su tumor, no según el tipo de cáncer que se les ha diagnosticado.
Los ensayos clínicos convencionales investigan los efectos de un nuevo tratamiento en pacientes con cáncer en un órgano o tejido específico. Algunos científicos temen que cuando la mayoría de los pacientes no tienen la mutación genética a la que se dirige el medicamento, tales ensayos puedan enmascarar los beneficios de los medicamentos dirigidos, ya que no responderán al medicamento. Una posible solución, reclutar solo a pacientes que alberguen la mutación, a menudo rara, en un tejido en particular, termina siendo ineficiente y costosa.
Usando este enfoque, “es difícil inscribir en un ensayo clínico a suficientes pacientes para llegar a una conclusión”, dice Robert Beckman, oncólogo y bioestadístico del Centro Médico de la Universidad de Georgetown. “Si solo hay 15 pacientes en el mundo con una enfermedad, ¿cómo puede llegar a saber con significancia estadística que una terapia está funcionando?” Beckman lidera un grupo internacional de aproximadamente 200 investigadores enfocados en generar nuevos diseños de ensayos clínicos que mejoren la eficiencia en el desarrollo de fármacos.
Un ensayo de canasta ofrece a los investigadores la oportunidad de estudiar directamente el efecto de un medicamento agrupando a los pacientes con cánceres según la genética de su tumor, independientemente de su localización. “Cuando emprendes un ensayo canasta, básicamente estás diciendo que la información genética es más importante que el sitio del tumor”, dice Beckman.
Otra ventaja de los ensayos de canasta es la posibilidad de aprovechar el éxito de una terapia en un tipo de cáncer para tratar otros tumores malignos. El gen BRAF, por ejemplo, está mutado en aproximadamente la mitad de los casos de melanoma, y en aproximadamente 5 a 10% de los cánceres de colon. También se han encontrado mutaciones BRAF en algunos cánceres de pulmón, cánceres de cerebro y linfoma no Hodgkiniano. (Un ensayo clínico planificado de fase II ahora está investigando una combinación de medicamentos en múltiples cánceres con una rara mutación BRAF).
“Si tiene un medicamento para un tipo de cáncer con cierta característica molecular, ¿se puede usar para tratar otros tipos de cáncer?” pregunta el oncólogo Keith Flaherty de la Facutad de Medicina de Harvard y el Centro de Cáncer Dana-Farber en Boston, que ha ayudado a diseñar ensayos clínicos para responder a esta pregunta.
Señales y factores de confusión
Los expertos señalan que el ensayo de Keytruda, el primer medicamento aprobado en 2017 que se utiliza para tratar cánceres independientemente de su localización fue un éxito rotundo. Keytruda desactiva los frenos de las células inmunes del cuerpo, capacitando a las propias defensas para detectar y atacar las células cancerosas. En 2013, tras obtener resultados prometedores que sugerían que el medicamento podía extender la vida de las personas con melanoma, un cáncer de piel a menudo mortal con pocas opciones de tratamiento, los investigadores estaban ansiosos por probarlo en otros tipos de cáncer. Sus esfuerzos dieron sus frutos: los estudios posteriores sugirieron que los pacientes con algunos cánceres de pulmón, de riñón y de vejiga podrían vivir más tiempo con la terapia.
Esa evidencia provocó que se hiciera un ensayo de canasta que involucró a 149 pacientes con un total de 15 tipos diferentes de cáncer. Para calificar, los pacientes debían tener mutaciones asociadas con una deficiencia de reparación de los errores de emparejamiento (MMR), una condición que impide que una célula pueda corregir adecuadamente las mutaciones de ADN relacionadas con el crecimiento del cáncer. Alrededor del 40% de los pacientes se beneficiaron de Keytruda, proporcionando evidencia suficiente para que la FDA le otorgara una aprobación acelerada, un proceso por el cual un medicamento puede estar disponible para los pacientes antes de que se hayan analizado todos los datos de supervivencia.
“Ese medicamento es tan espectacular, y la necesidad insatisfecha era tan grande, que la FDA realmente no requirió el mismo rigor que exigen a otros medicamentos”, dice Beckman. “Era muy evidente que estos medicamentos eran muy útiles”.
A este le siguió otro éxito. A fines de 2018, la FDA aprobó un segundo oncológico que actuaba independientemente de la ubicación del cáncer, Vitrakvi, para pacientes que han agotado otras opciones de tratamiento y cuyos tumores sólidos tienen lo que se llama fusión de genes NTRK, donde un gen llamado NTRK se separa de un cromosoma y se une a otro. El proceso produce las llamadas proteínas TRK, que pueden promover el crecimiento del cáncer. Esa aprobación se basó en los resultados en 55 pacientes, que representaron 12 tipos diferentes de cáncer, y participaban en tres pequeños ensayos canasta en curso. A las ocho semanas, en 12 pacientes habían desaparecido por completo todos los signos observables de cáncer; en otros 29 pacientes, los tumores disminuyeron de tamaño.
Usando la estrategia de ensayo de canasta, ahora se están probando una serie de medicamentos diferentes, que se dirigen a cambios moleculares específicos involucrados en numerosos tipos de cáncer, para una variedad de tumores.
Sin embargo, no todos los ensayos de canasta han aportado medicamentos efectivos, dice el oncólogo Aaron Mansfield de la Clínica Mayo en Rochester, Minnesota. De hecho, ha habido algunos fracasos frustrantes.
En 2012, los investigadores franceses lanzaron el ensayo SHIVA, un ensayo canasta, aleatorio, diseñado para medir si los medicamentos dirigidos contra el cáncer, utilizados fuera de etiqueta, podían extender la supervivencia sin progresión (la cantidad de tiempo que transcurre después del tratamiento hasta que el cáncer empeora). Se inscribieron más de 700 pacientes y se les secuenciaron los tumores. Alrededor de 200 pacientes con mutaciones que eran blanco de medicamentos existentes se dividieron en dos grupos. Aproximadamente la mitad recibió la atención estándar, y el resto recibió un medicamento que no había sido aprobado para su tipo de enfermedad pero que fue diseñado para atacar una de sus mutaciones genéticas.
Los resultados de este gran ensayo de alto perfil fueron pésimos. Después de 11 meses, los pacientes a los que se les habían recetado medicamentos dirigidos tenían la misma probabilidad que los demás de tener síntomas recurrentes relacionados con el cáncer y más probabilidades de experimentar efectos secundarios graves o incluso mortales. Esto hizo que los investigadores del estudio desalentaran, en general, el uso de las terapias dirigidas fuera de etiqueta.
“No pasó nada” ninguno de los medicamentos que se probaron funcionó, dice Flaherty.
Sin embargo, SHIVA no fue una pérdida total, dice Doherty, quien recientemente fue coautora de un artículo en la Revisión Anual de Bioquímica sobre el tratamiento del cáncer en la era de la genómica. “Los resultados nos dijeron que incluso si el mismo biomarcador genómico de un tejido está presente en otro, no quiere decir que se pueda actuar sobre ambos”, dice. En otras palabras, una mutación en un tumor podría estar impulsando el crecimiento y la propagación de la enfermedad, mientras que la misma mutación en otro podría no desempeñar un papel tan importante.
También aportó resultados mixtos el estudio canasta más grande hasta la fecha, mejor descrito como un estudio canasta de canastas: el ensayo de National Cancer Institute Molecular Analysis for Therapy Choice, o NCI-MATCH. Flaherty es el investigador principal, y el estudio fue diseñado para encontrar fármacos prometedores para una variedad de sitios tumorales.
Empezó en 2015, desde entonces ha inscrito a más de 6.000 pacientes, y ha secuenciado genéticamente todos sus tumores. A principios de 2020, se estaban formando casi una docena de grupos de tratamiento independientes, cada brazo del estudio probaba el efecto de un medicamento dirigido sobre una mutación específica. Mientras SHIVA asignó aleatoriamente los medicamentos dirigidos a los pacientes simplemente porque tenían una sola mutación en común, en el ensayo MATCH solo se administraron medicamentos a los pacientes si estudios previos en el laboratorio y en animales sugirieron que podrían ser beneficiosos.
En noviembre de 2018, los investigadores informaron que el tratamiento con capivasertib, un medicamento que interfiere con una vía de señalización celular que promueve el crecimiento del cáncer, hasta ese momento había llevado a la contracción del tumor en 8 de los 35 pacientes que lo tomaron, hallazgos lo suficientemente prometedores como para justificar futuros estudios. Pero en otro brazo del estudio, ninguno de los 65 pacientes tratados con taselisib, un medicamento experimental que parecía prometedor en estudios de laboratorio y animales contra una mutación en un gen llamado PIK3Ca experimentaron una reducción de sus tumores. Otros brazos han tenido resultados igualmente débiles.
de Aquiles que los ensayos preclínicos sugirieron que sería, pero “incluso una tasa de respuesta del cero por ciento le dice algo”, dice Flaherty.
Canasta mixta
Los investigadores no están de acuerdo en cómo interpretar estos resultados mixtos. Una posibilidad es que algunas de las primeras pruebas de canasta tuvieran fallas de diseño. Muchos expertos culpan a los hallazgos en SHIVA en la incapacidad de recopilar suficiente evidencia de estudios preclínicos en animales para justificar el uso de los medicamentos testados.
En términos más generales, debido a la forma en que se agrupan los datos de los diferentes brazos de tratamiento, los ensayos de canasta pueden no ser estadísticamente tan sólidos como los ensayos convencionales de fase II. También pueden ser más vulnerables a falsos positivos o a inflar erróneamente los beneficios. Y no revelan el significado biológico de las mutaciones ni muestran por qué los participantes en una canasta responden mientras que los de otra no.
Pero Doherty cree que muchos de los obstáculos pueden superarse. Dice que experiencias pasadas han demostrado que un buen ensayo de canasta necesita tener suficientes participantes para que los hallazgos sean confiables, un diseño claro, que incluya objetivos bien definidos y evidencia preclínica que sugiera que el medicamento funcionará en los pacientes que alberguen una mutación específica.
Flaherty dice que los ensayos de canasta, junto con la información de otros análisis genéticos, pueden llenar vacíos importantes en la comprensión que tienen los investigadores de qué mutaciones hacen qué, cuándo y en qué tipos de cáncer. Y espera que estos estudios revelen las formas óptimas de aportar tratamientos nuevos a tantos pacientes como sea posible.
Referencia