Agencias Reguladoras
Los esfuerzos del gobierno federal aceleran la elaboración de las vacunas y tratamientos, pero se necesita mayor transparencia en las autorizaciones para uso en emergencia.
Lo que la Government Accountability Office (GAO) descubrió.
A través de Operation Warp Speed (OWS) —una colaboración entre el Departamento de Salud y Servicios Humanos (HHS) y el Departamento de Defensa (DOD)— el gobierno federal agiliza los esfuerzos para elaborar vacunas y tratamientos contra el Covid-19. Aproximadamente, el proceso habitual de elaboración de una vacuna puede tardar 10 años o más, pero los esfuerzos de Operation Warp Speed buscan acelerar este proceso, en gran medida completando pasos esenciales de manera simultánea (véase el gráfico).
El 15 de octubre de 2020, Operation Warp Speed anunció al público que daría apoyo financiero para el desarrollo o la producción de seis candidatas a vacunas contra el Covid-19, por una suma total de más de US$10.000 millones. Además, anunció el apoyo financiero para el desarrollo de tratamientos, como los US$450 millones destinados a la fabricación del tratamiento con anticuerpos monoclonales (un tratamiento que utiliza anticuerpos elaborados en el laboratorio, que también podría utilizarse como opción preventiva).
Nota: Una autorización para uso en emergencia permite la de un producto médico que no tiene la aprobación o licencia de la FDA mientras dure una emergencia declarada, y siempre y cuando se cumplan ciertos criterios legales.
Cronograma de Operation Warp Speed para una posible candidata a vacuna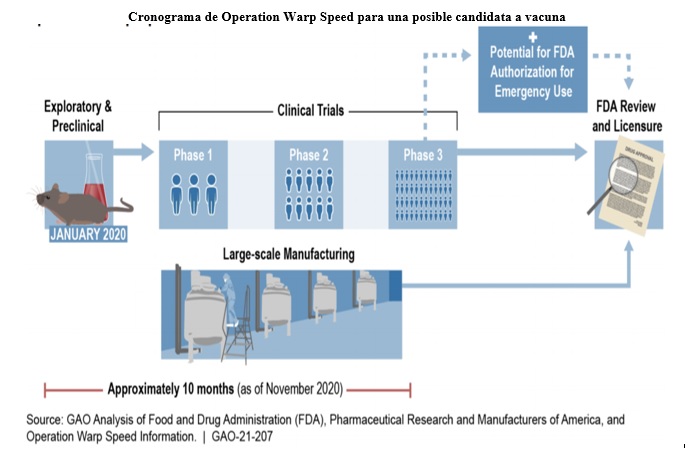
Temporalmente, la FDA puede permitir el uso de vacunas y tratamientos contra el Covid-19 sin licencia o no aprobados, a través de las autorizaciones de uso en emergencia (AUE), siempre que haya evidencia de que los productos son eficaces y los beneficios potenciales superan los riesgos. En el caso de las vacunas, en octubre de 2020 la FDA elaboró una guía que ofrece recomendaciones a los patrocinadores sobre como presentar la evidencia que la FDA necesita para emitir una AUE.
Para los tratamientos, la FDA ha emitido cuatro AUEs desde el 9 de noviembre de 2020. La evidencia para apoyar las decisiones de autorizar tratamientos contra el Covid-19 por parte de la FDA no siempre ha sido transparente, en parte porque la agencia no divulga de manera uniforme la revisión científica de los datos de seguridad y eficacia para otorgar una AUE, como lo hace cuando aprueba medicamentos y fármacos biológicos nuevos. Debido a la gravedad de la pandemia, es importante que la FDA encuentre la manera de revelar esta información al público de manera correcta. Al hacerlo, la agencia podría mejorar la transparencia de las decisiones sobre sus AUE, y asegurar la confianza de la ciudadanía.