Agencias Reguladoras
EE UU y Canadá
EE UU. FDA lanzó guía de biosimilares intercambiables
Paola Velásquez
Consultor Salud, 14 Mayo, 2019
https://consultorsalud.com/fda-lanzo-guia-de-biosimilares-intercambiables/
La FDA finalizó una guía muy esperada que detalla cómo los biosimilares pueden lograr un estado intercambiable, lo que significa que pueden ser sustituidos por el producto biológico de referencia sin la intervención de un prescriptor.
Sin embargo, el ex comisionado de la FDA, Scott Gottlieb, dijo que es probable que los productos de insulina intercambiables lleguen a EE UU Estados Unidos en los próximos años. Y la orientación final sobre intercambiabilidad proporcionará a los patrocinadores más certeza sobre cómo desarrollar productos intercambiables.
Objetivo de la Guía de la FDA
El objetivo fundamental de la Guía de Medicamentos Biosimilares para la Farmacéuticas es aportar un documento que sirva como referente a todas las instituciones, sea cual sea su actividad profesional o modalidad de ejercicio profesional, y les aporte los conocimientos esenciales de los principios farmacológicos y de regulación de los medicamentos biosimilares, así como su contribución a la sostenibilidad del Sistema Nacional de Salud (SNS)
Cambios en la orientación final según la FDA
No obstante, aunque esta guía es corta, los comentaristas se mostraron en desacuerdo ante el borrador, debido a los términos empleados allí, como “incertidumbre residual” y “similar a una huella digital”, que se utilizan en el borrador para describir la similitud entre el producto intercambiable propuesto y el producto de referencia, pues manifiestan necesitan mayor claridad.
Sin embargo, la guía final ya no usa el término “como huella digital” y mientras que el borrador incluye casi 20 referencias a “incertidumbre residual”, esta guía incluye solo una. “La agencia también considera los numerosos comentarios sobre la orientación para la adopción de intercambio e hizo cambios para proporcionar una mayor claridad a las partes interesadas”.
Biosimilares intercambiables
Por su parte la directora ejecutiva del Consejo de Biosimilares, Christine Simmon, aplaudió la “orientación oportuna de la FDA sobre la intercambiabilidad de biosimilares, en particular sus datos simplificados y los requisitos de diseño de estudios que permiten la flexibilidad y el uso de productos de comparación global para respaldar aplicaciones”.
Las compañías que comentaron sobre el borrador también se opusieron al requisito de que debían usar productos de referencia con licencia de EE UU en un estudio (o estudios) de cambio. Y la FDA ha modificado este requisito en la guía final, cambiado el nombre a esa sección de la guía.
Por su parte, el analista de biotecnología de Bernstein Ronny Gal agregó en una nota a los inversionistas: “El principal requisito agregado es un ensayo de cambio de 2 brazos donde todos los pacientes comienzan con el producto de referencia. En un brazo, los pacientes permanecerán en el producto de referencia en todo momento. En el otro, cambiarán de un lado a otro dos veces, terminando con el producto biosimilar. Críticamente, la comparación principal es con los marcadores PK / PD, no con los marcadores de eficacia (que la FDA considera menos sensibles). Esto reducirá significativamente los costos de realizar estas pruebas “.
También dijo que espera que esta guía permita el intercambio de insulina y permita versiones intercambiables de “algunos de los anticuerpos más fáciles de replicar como Eylea”.
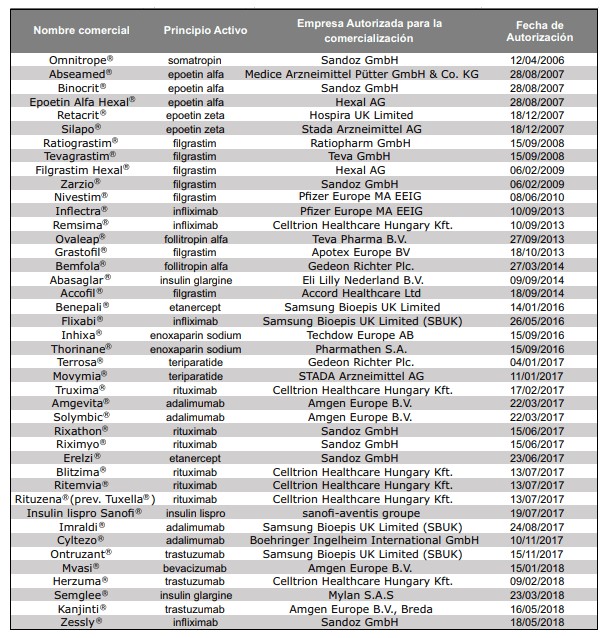
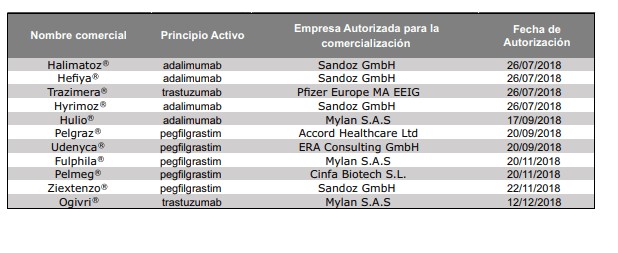
Medicamentos biosimilares autorizados por la CE
Hace ya más de una década que fue aprobado el primer biosimilar en la UE, la hormona del crecimiento, en 2006. A fecha de enero de 2019, en la UE, hay 53 biosimilares de 16 productos originales (adalimumab, bevacizumab, enoxaparina sódica, epoetina alfa, epoetina zeta, etanercept, filgrastim, folitropina alfa, infliximab, insulina glargina, insulina lispro, pegfilgrastim, rituximab, somatropina, teriparatida y trastuzumab) aprobados por la Comisión Europea (CE) mediante procedimiento centralizado.