ÉTICA Y DERECHO
Publicidad y promoción
Los ensayos clínicos, Xigris, mortalidad evitable
AISLAC, 3 de noviembre 2011
http://www.aislac.org/index.php?option=com_content&view=article&id=681:los-ensayos-clinicos-xigrisr-mortalidad-evitable&catid=141:noticias-2011&Itemid=207
España, noviembre del 2011. Juan Gérvas de la Escuela Nacional de Sanidad y de la Universidad Autónoma de Madrid, recuerda la importancia de los ensayos clínicos en la autorización de los medicamentos, a la luz del retiro del medicamento Xigris®,al comprobarse que no reduce la mortalidad por septicemia
Xigris® (drotrecogina alfa activada) fue aprobada por la FDA en el 2001, pese a las recomendaciones de más de la mitad de los 20 científicos que revisaron dicho medicamento, quienes exigieron la realización de un nuevo ensayo clínico que despejara las numerosas dudas existentes.
La FDA aprobó el medicamento para la “reducción de la mortalidad en pacientes adultos con sepsis severa (sepsis asociada a la disfunción aguda de órganos) quienes tienen un alto riesgo de muerte”. Esta indicación resultó para la farmacéutica Eli Lilly en ventas de Xigris® inferiores a lo esperado.
Para revertir dichos resultados comerciales, Eli Lilly empleó “estrategias de marketing disfrazadas de medicina basada en la evidencia”, iniciando en el 2002 con la formación del “Grupo de trabajo sobre los valores éticos y el racionamiento de los cuidados críticos” que contó con un financiamiento de $1.8 millones por parte de la farmacéutica; este grupo se encargaba de denunciar la limitación en el uso de Xigris. Un año después, expertos en cuidados intensivos de todo el mundo fueron convocados para elaborar una “Guía del manejo de la sepsis”, publicada en el 2004 en la revista Critical Care Medicine. “Lilly aportó el 90% de los fondos, explicaron los investigadores”.
La estrategia calificada como antiética por la revista New England Journal of Medicine, y E-farmacos, tuvo como resultado un incremento significativo de las ventas, tal como se aprecia en el gráfico publicado por la revista “America’s New Refugees — Seeking Affordable Surgery Offshore”.
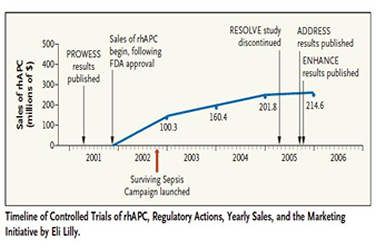
En el 2008, la agencia europea solicitó la realización de un estudio para despejar las dudas sobre la eficacia de Xigris® como condición para mantener la autorización de comercialización. Así surgió el estudio PROWESS-SHOCK, cuyos resultados demostraron que Xigris® no reduce la mortalidad por septicemia.
Para la farmacéutica, el desarrollo de nuevas tecnologías elevaron el estándar de tratamiento de la sepsis, lo que coloca a Xigris® en desventaja con los resultados hoy conocidos. Por ello la farmacéutica anunció el retiro de su producto de los mercados internacionales; pero de lo que aún no se habla es de la mortalidad innecesaria por el uso del Xigris, el cual se calcula en cientos o miles por el uso de este medicamento.
Eli Lilly y la práctica antiética
En el 2008, Eli Lilly tuvo que pagar US$1420 millones para resolver los cargos penales y civiles por promocionar de manera antiética su medicamento Zyprexa® (olanzapina), el cual estaba autorizado para el tratamiento de esquizofrenia, desorden bipolar, agitación asociada con esquizofrenia y desorden bipolar–Manía I. Sin embargo, el medicamento fue promocionado adicionalmente para uso en niños con problemas de comportamiento y en ancianos con “comportamientos rebeldes”.
Extraído de: