Globalización y Ensayos Clínicos
Los datos sugieren que las iniciaciones de ensayos de terapia celular y genética en Europa van a la zaga de América del Norte: éstas son las razones (Data suggest gene, cell therapy trial initiations in Europe lag behind North America — here’s why)
Natalie Grover
Endpoints, 4 de noviembre de 2019
https://endpts.com/gene-cell-therapy-trial-initiations-in-europe-lag-behind-north-america-study-finds/
Traducido por Salud y Fármacos
La ciencia médica ha hecho una transición y en lugar de buscar soluciones que puedan ser útiles para todos se está enfocando en la medicina personalizada. Las autoridades europeas aprobaron la primera terapia génica del mundo y, hasta ahora, la EMA ha otorgado la mayor cantidad de permisos de comercialización de terapias avanzadas con medicamentos, o medicamentos basados en genes, tejidos o células, a nivel mundial. Pero los datos sugieren que en los últimos años el número de ensayos clínicos de terapias avanzadas con medicamentos iniciados en Europa se ha visto eclipsado por los que se hacen en América del Norte.
El análisis, realizado por una organización de defensa con sede en Washington DC y Bélgica llamada Alianza para Medicina Regenerativa (Alliance for Regenerative Medicine ARM), incluyó una evaluación de los ensayos clínicos activos que incluyen intervenciones de terapias avanzadas con medicamentos de terapias avanzadas con medicamentos que se iniciaron entre enero de 2014 y junio de 2019, así como una encuesta a 22 miembros de la ARM, 16 de los cuales representan organizaciones que patrocinan ensayos clínicos en Europa.
Aunque hay aproximadamente el doble de empresas que desarrollan terapias avanzadas con medicamentos con sede en América del Norte que, en Europa, el número de ensayos clínicos iniciados en Europa es solo un tercio de los que se han comenzado en América del Norte, según el informe de la ARM.
Entre 2014 y 2018, el número de ensayos clínicos de terapias avanzadas con medicamentos iniciados aumentó en aproximadamente un 32% a nivel mundial, impulsado por América del Norte y Asia.
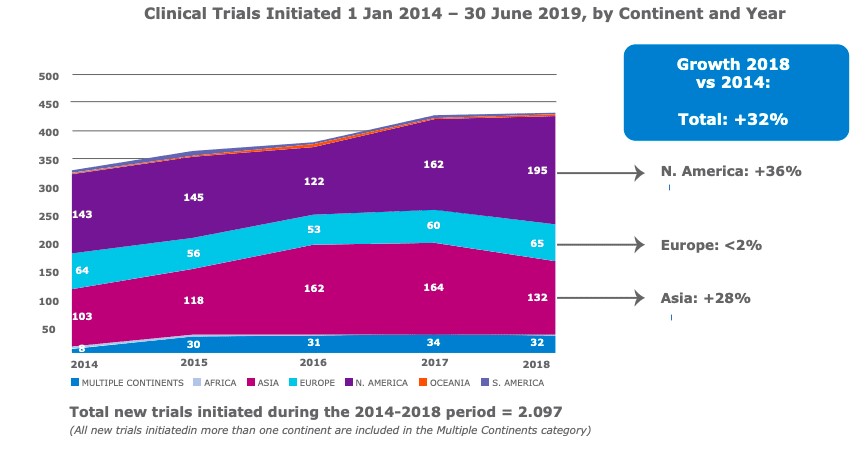
“La mayor parte del crecimiento se ha producido en América del Norte y Asia y no tanto en Europa… para mí, eso indica que hay una falta de competitividad en comparación con otras regiones”, dijo Annie Hubert, directora sénior de Política Pública Europea en ARM, en una entrevista con Endpoints News.
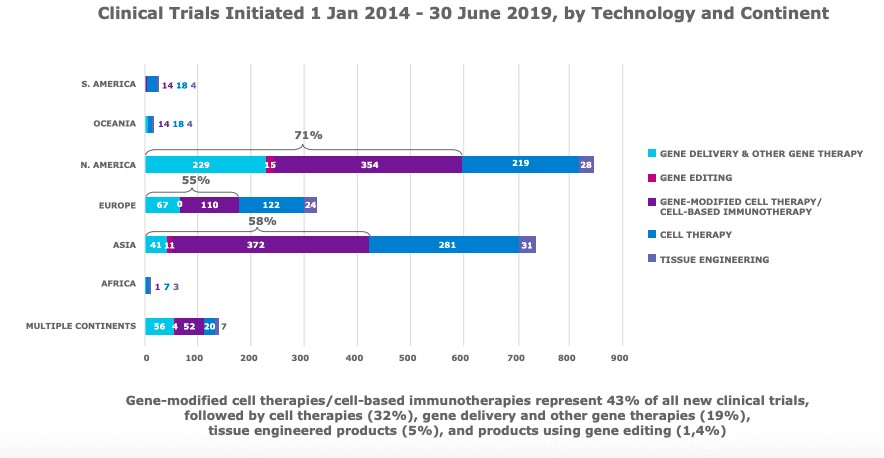
Específicamente en referencia a las terapias genéticas, hubo proporcionalmente más ensayos clínicos (que utilizan la entrega de genes, la edición de genes y las tecnologías de terapia celular modificada por genes) en América del Norte que en Europa.
En conjunto, estos datos corroboran lo que la mayoría de los miembros de la ARM han experimentado en los últimos años, dijo Hubert. La ARM tiene unos 350 miembros.
La ARM ha compartido los datos con algunos reguladores, incluyendo la EMA y la Comisión Europea, agregó. “Y tengo que decir que, en términos generales, no fue una gran sorpresa”.
Regulaciones de ensayos clínicos en la Unión Europea
A diferencia de EE UU, la Unión Europea (UE) es un lugar complejo para realizar ensayos clínicos, sin importar el tipo de terapia que desee desarrollar. Esto se debe a que, si los ensayos incluyen pacientes de más de un país de la UE, los fabricantes de medicamentos tienen que obtener la autorización de cada una de las naciones de la UE para realizar sus estudios.
Este sistema, sin embargo, está en limbo. En 2014, la UE hizo cumplir la legislación que armoniza la evaluación y supervisión de los ensayos clínicos de la UE a través del portal de ensayos clínicos y la base de datos. Sin embargo, los diversos retrasos por dificultades técnicas con el desarrollo de los sistemas de información han atrasado su implementación hasta 2020-2021.
“La terapia génica, en particular, está dejando su fase inicial en enfermedades huérfanas y súper huérfanas, y entrando en lo que llamamos de desarrollo medio (medium-rare), en la que las cosas se están probando en miles y, a veces, en cientos de miles de pacientes”, señaló Dmitry Kuzmin, socio gerente de VC 4BIO Capital, con sede en Londres, que se centra en terapias avanzadas.
“Y si piensas en esas condiciones, naturalmente, eso llevaría a ensayos multicéntricos en varios países porque las aprobaciones ya no se van a hacer en base a los resultados en solo 20-25 pacientes”. Estamos pensando en ensayos clínicos de tamaño considerable, hasta con 200 pacientes… esto exige más ensayos en EE UU”, dijo en una entrevista con Endpoints News.
EE UU también es el mercado más grande de productos farmacéuticos, señaló Owen Smith, director de inversiones de 4BIO. “El acceso armonizado a un gran número de pacientes en EE UU es deseable para las empresas con una serie de productos en investigación, y la presencia de una serie de enfermedades raras lo convierte en un lugar bastante atractivo para realizar esos estudios”.
“Y creo que algunos inversores pueden estar más nerviosos al invertir en empresas que están realizando estudios en diferentes lugares europeos”, agregó. (Nota de Salud y Fármacos: las empresas innovadoras suelen hacer ensayos en muchos países simultáneamente)
El proceso en la UE podría volverse más espinoso cuando las nuevas regulaciones de dispositivos médicos y diagnóstico in vitro entren en vigor en 2022.
Para los patrocinadores que usan pruebas diagnósticas en sus ensayos, o están desarrollando terapias que deben administrarse utilizando dispositivos médicos, “la interacción entre la regulación de ensayos clínicos y la regulación de diagnóstico in vitro es algo que podría complicar las cosas” dijo Hubert.
Europa también es una anomalía porque las terapias genéticas se clasifican como Organismos Genéticamente Modificados (OGMs), lo que requiere la aprobación específica de las autoridades de los OGM, lo que agrega otra capa de complejidad al proceso de inicio del ensayo clínico.
El proceso de solicitud de los OGM es engorroso y en algunos países, como los Países Bajos, puede consumir mucho tiempo, dijo a Endpoints News Anne-Virginie Eggimann, vicepresidenta senior de ciencia reguladora de Bluebird Bio, desarrollador de terapia génica.
“Se puede tardar hasta un año en obtener la autorización de un OGM, además de la autorización de su ensayo clínico. En general, si tiene que intervenir un OGM, está bien. Pero sería ideal si se alienara con el cronograma del ensayo clínico, bajo la misma autoridad”.
Los datos de ARM muestran que los tiempos de aprobación para un nuevo ensayo clínico en Europa varían de menos de 30 días a más de un año, con un tiempo de aprobación promedio de tres a seis meses.
En términos de inicio de ensayos dentro de Europa, algunos países más pequeños funcionan mejor en relación con su tamaño, como por ejemplo Bélgica, Dinamarca y Suiza, que atraen proporcionalmente más ensayos clínicos de terapias avanzadas con medicamentos nuevos per cápita que otros países, incluyendo América del Norte. Mientras tanto, Israel tiene el mayor número de nuevos ensayos clínicos de terapias avanzadas con medicamentos per cápita en el mundo, sugirió el análisis.
La mayoría de los inversores tienden a ignorar países como los Países Bajos, Bélgica, Dinamarca y Suecia, señaló Kuzmin de 4BIO. “Las personas tienden a descartar a los países europeos más pequeños como innovadores… ecosistemas de ensayos clínicos, pero en realidad pueden superar su tamaño”.